La diabetes mellitus tipo 1 (DM1) es una enfermedad crónica de base autoinmune en la que se produce la destrucción de los islotes beta pancreáticos con el consiguiente déficit de insulina, de manera que el organismo no es capaz de mantener la glucemia y en consecuencia la normalidad metabólica. Pero hay que tener en cuenta que las alteraciones hormonales en la DM1 no se limitan exclusivamente a la deficiencia de insulina, sino también existe una secreción inadecuada de glucagón en el período postprandial.
El tratamiento fundamental de la DM1 es la administración exógena de insulina simulando en lo posible su producción fisiológica, cubriendo las necesidades basales y postingestas. Una terapia nutricional individualizada y el ejercicio físico realizado en condiciones óptimas son los otros dos pilares del tratamiento. El objetivo terapéutico de la DM1 es conseguir un control glucémico lo más próximo a la normalidad sin hipoglucemias para evitar tanto las complicaciones agudas como las crónicas micro y macrovasculares. Se recomienda un tratamiento intensivo desde el debut de la enfermedad que consiste en la administración de múltiples dosis de insulina (MDI) o sistema de infusión continuo (ISCI), con monitorización continua de glucosa a tiempo real (MCG) o intermitente y en caso de no disponibilidad en su defecto, automonitorización capilar diaria, todo ello acompañado de una adecuada educación diabetológica1. La insulina exógena a diferencia de la insulina endógena es administrada por vía subcutánea, sin lograr una concentración adecuada en la circulación portal. Además su liberación no es regulada por la glucosa plasmática con el consiguiente riesgo de hipoglucemias. A pesar de los múltiples avances terapéuticos como los nuevos análogos de insulinas disponibles basales y prandiales, y los tecnológicos que han ido apareciendo en las últimas décadas, un porcentaje elevado de pacientes de hasta el 80% no consigue alcanzar los estrictos objetivos de control glucémico recomendados2. La media de HbA1c de los pacientes de todas las edades oscila en torno al 8.4% según el registro norteamericano T1DExchange2 y se ha estimado en otros registros internacionales que más del 25% de los sujetos incluidos tendría un control glucémico muy deficiente con HbA1c superiores al 9%3. La tasa de complicaciones agudas, ingresos por hipoglucemias graves y cetoacidosis, sigue siendo elevada2,3. Los tratamientos actuales no han logrado suprimir de forma definitiva las fluctuaciones glucémicas en el día a día, y esa variabilidad glucémica conlleva efectos perniciosos sobre la salud cardiovascular. Por otro lado, cada vez son más frecuentes las comorbilidades en los pacientes con DM1 como el sobrepeso y la obesidad (1 de cada 3 personas con diabetes en edad pediátrica y 2 de cada 3 adultos padecen un exceso de grasa corporal) en parte debido a la hiperinsulinemia periférica, la hipertensión arterial, la dislipidemia aterogénica y otros componentes del síndrome metabólico4-9. La presencia concomitante de estos factores de riesgo cardiovasculares impacta de forma negativa en la calidad y esperanza de vida de los pacientes9. Pero hay que tener en cuenta que incluso sin comorbilidades, los sujetos con DM1 tienen un riesgo elevado de presentar enfermedades cardiovasculares isquémicas, insuficiencia cardiaca y una mayor mortalidad cardiovascular y por todas las causas frente a los controles sanos. A medida que aumenta el número de estas comorbilidades, la posibilidad de padecer un evento cardiovascular no mortal o mortal se incrementa de manera drástica. Incluso en aquellos pacientes con un control metabólico óptimo, el riesgo de mortalidad es del doble comparado con los controles10.
La existencia de estas múltiples necesidades no cubiertas con las pautas actuales de MDI o ICSI ha motivado la búsqueda de alternativas terapéuticas coadyuvantes al tratamiento de la DM111. Se han estudiado fármacos con amplia experiencia clínica en los pacientes con DM2 que por sus mecanismos de acción y beneficios extraglucémicos sobradamente ratificados, brindarían la oportunidad de imitar más de cerca la fisiología pancreática normal y contrarrestar otros mecanismos fisiopatológicos diferentes a la insulinopenia, reducir las dosis de insulinas y mejorar el control glucémico a expensas de la variabilidad glucémica. Además de estos argumentos, determinadas terapias complementarias podrían ayudar a la optimización de los factores de riesgo metabólicos asociados y mejorar la calidad de vida de los pacientes. Si los beneficios cardio-renales demostrados en la DM2 con reducción de la morbimortalidad cardiovascular con dos familias terapéuticas como son los agonistas del receptor de GLP-1 (ARGLP-1) y los inhibidores del sodio-gluco-transportador tipo 2 (iSGLT-2) pueden ser extrapolables a la DM1, actualmente carecemos de evidencia al respecto12. Aunque si los beneficios en reducción de deterioro de la función renal, insuficiencia renal, muerte cardiovascular y hospitalización por insuficiencia cardíaca en pacientes adultos sin diabetes con enfermedad renal crónica en riesgo de progresión, han condicionado la aprobación de algunos iSGLT-2 como dapaglifozina y empaglifozina en población no diabética, cabría esperar al menos efectos positivos similares en pacientes con DM1. Sin lugar a duda, en los próximos años se deberán plantear en ensayos clínicos bien diseñados estos desafíos clínicos para poder responder a las incertidumbres generadas, ya que tanto algunos ARGLP1 (liraglutida, dulgalutida y semaglutida subcutáneas) como los glucosúricos pueden alterar favorablemente el curso natural del “continuum” cardiovasculorenal de la DM1 12.
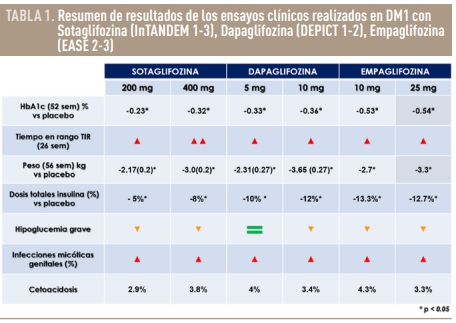
De toda la farmacopea de la DM2 que ha demostrado, tanto en ensayos clínicos como en estudios en vida real realizados en población con DM1, las mayores ventajas y solventar algunas de las necesidades no cubiertas descritas, destacarían sobre el resto los iSGLT-2 o glucosúricos11. Estos fármacos consiguen reducciones de HbA1c que varían entre 0.32% a 0.5%, algo inferiores a las obtenidas en los estudios pivotales en DM2, pérdida de peso de 2.5 kg con dosis bajas a 3-3.5 kg con dosis altas, menores dosis totales de insulina, descenso en la frecuencia de hipoglucemias graves y como valor añadido una reducción de la variabilidad glucémica 13-16 (Tabla 1). Por otro lado, aumentan el riesgo de presentar infecciones genitales micóticas, pero no las urinarias. Sin embargo, la complicación que ha frenado hasta ahora su aprobación por la FDA (US Food and Drug Administration) es el incremento de 2-4 veces del riesgo de cetoacidosis. En concreto la cetoacidosis euglucémica que puede acontecer en estos pacientes más frecuentemente ha llegado a retrasar el diagnóstico precoz, motivando un peor pronóstico. El riesgo absoluto de cetoacidosis diabética con iSGLT-2 en DM1 es aproximadamente del 4% anual11,16. A pesar de esta complicación, el balance entre beneficios obtenidos y riesgos se inclina a favor de las ventajas según se demuestra en su uso cada vez más frecuente en la práctica clínica fuera de indicación y previo consentimiento informado del paciente. Se han ido publicando en los últimos años recomendaciones terapéuticas por parte de varias sociedades científicas para minimizar el riesgo de cetoacidosis y adiestramiento de los pacientes en el uso apropiado de los glucosúricos17. La implementación de estas estrategias para mitigar la cetoacidosis ha demostrado ser eficaz y debe ser obligatoria ante cualquier paciente al que se le prescriba un glucosúrico adicionalmente al régimen de insulina. Uno de los requisitos para conseguir el éxito terapéutico, es una precisa selección del paciente candidato. En marzo del 2019, la Comisión Europea aprobó el uso adyuvante de Dapaglifozina a dosis de 5 mg/día a la insulinoterapia en individuos con DM1 mayores de 18 años, con control glucémico subóptimo y un índice de masa corporal (IMC) de al menos 27 kg/m2. Es por tanto el primer fármaco oral que puede usarse de forma complementaria en DM1 en Europa, aunque en otros países sigue bajo revisión de las agencias regulatorias. Probablemente, ante el empleo cada vez más extenso de los glucosúricos en DM1 fuera de indicación y con los resultados tan esperanzadores que se están publicando en los últimos años de cardio y nefroprotección en pacientes con DM2 y sin DM, se debería replantear su aprobación. Teniendo en cuenta el exceso de morbimortalidad cardiovascular implícita en la DM1, por ende, debería ser considerada población diana para el tratamiento con iSGLT-2.
La metformina constituye uno de los pilares fundamentales en el manejo de la DM2, que por sus propiedades, mecanismos de acción, beneficios clínicos y coste, lo han posicionado en primera línea en todos los algoritmos de tratamiento. Sin embargo, en los estudios realizados en población con DM1, estos resultados no se han traducido en un impacto significativo clínico que pueda revolucionar el manejo de los pacientes. La adición de metformina a la insulinoterapia consigue reducciones discretas ponderales y del nivel de lípidos, disminución de dosis de insulina en torno a 0.47 unidades/día, pero con una eficacia similar glucémica en cuanto al descenso de HbA1c1,18. En algunos estudios se ha demostrado mejoría del riesgo cardiovascular y de la función endotelial en niños19. Pero estos datos no justifican su empleo concomitante a la insulinoterapia ya que los factores de riesgo cardiovasculares pueden optimizarse con los fármacos dirigidos expresamente a ello como estatinas o medicaciones antiobesidad.
En cuanto a las terapias inyectables subcutáneas, pramlintida es un derivado sintético análogo a la amilina humana, hormona sintetizada también por las células beta- pancreáticas que contribuye al control de la glucemia, y ha sido aprobada como terapia adyuvante por la FDA en adultos con DM11. No está comercializada en muchos países, entre ellos España. La escasa reducción de HbA1c (0-0.3%), pérdida ponderal discreta (1-2 kg), efectos adversos y administración parenteral han limitado su indicación y apenas tiene representación en el panorama terapéutico de la DM120. En cuanto a los ARGLP-1, la esperanza que se tenía depositada en ellos por su mayor eficacia metabólica, se ha visto truncada a tenor de los resultados de los ensayos clínicos realizados con liraglutida y exenatida21. La adición de estos fármacos consigue reducciones discretas de HbA1c en torno al 0.2% y de peso de unos 3 kg, las dosis de insulinas también se reducen levemente, pero se ha descrito un mayor número de hipoglucemias y episodios de cetoacidosis diabética. Estos pobres resultados metabólicos han contribuido a descartar su autorización por parte de las administraciones internacionales. Es cierto, que no se han publicado estudios con los ARGLP-1 más potentes desde el punto de visto cardiometabólico como son semaglutida y dulaglutida y de administración semanal. Por otro lado, los beneficios de protección cardiovasculares y renales demostrados en DM2 no pueden extrapolarse a los pacientes con DM1. Aunque teniendo en cuenta que en sujetos con obesidad sin DM cada vez se están confirmando resultados más esperanzadores en reducción de morbimortalidad cardiovascular, sería esperable también que en los pacientes con DM1 y obesidad, liragutida a dosis de 3 mg/d y semaglutida a dosis de 2.4 mg/d demuestren estos beneficios.
El futuro terapéutico de nuestros pacientes con DM1 es prometedor, aunque deberemos esperar a que se siga investigando con estos dos grupos de fármacos que han revolucionado el panorama del tratamiento en la DM2, redefiniendo las visiones cardiocéntrica y adipocéntrica frente a la posición denostada glucocéntrica. Cada vez son más frecuentes los pacientes con DM1 que presentan características metabólicas que les asemejan más a los sujetos con DM2, y ello implica que tanto los iSGLT-2 como los ARGLP-1 aportarían beneficios pluripotenciales para un manejo personalizado e integral del paciente. Claramente debemos entre todos mirar hacia delante e ir más allá de la insulina en el tratamiento de la DM1.
Bibliografía:
- American Diabefes Association. Pharmacologic Approaches toGlycemic Treatment:Standards ofMedical Care in Diabetes 2021. Diabetes Care 2021; 44 (Suppl. 1): S111–S124.
- Foster NC, Beck RW, Miller KM, et al. State of Type 1 Diabetes Management and Outcomes from the T1D Exchange in 2016-2018. Diabetes Technol Ther. 2019; 21(2): 66-72.
- McKnight JA, Wild SH, Lamb MJ, et al. .Glycaemic control of Type 1 diabetes in clinical practice early in the 21st century: an international comparison Diabet Med. 2015; 32(8): 1036-50.
- De Keukelaere M, Fieuws S, Reynaert N, et al. Evolution of body mass index in children with type 1 diabetes mellitus. Eur J Pediatr. 2018; 177(11): 1661-1666.
- Maffeis C, Birkebaek NH, Konstantinova M, et al SWEET Study Group. Prevalence of underweight, overweight, and obesity in children and adolescents with type 1 diabetes: Data from the international SWEET registry. Pediatr Diabetes. 2018; 19: 1211-1220.
- Grabia M, Markiewicz-Żukowska R, Socha K. Prevalence of Metabolic Syndrome in Children and Adolescents with Type 1 Diabetes Mellitus and Possibilities of Prevention and Treatment: A Systematic Review. Nutrients 2021; 13(6):1782-1797.
- Castro-Correia C, Santos-Silva R, Pinheiro M, Costa C, Fontoura M. Metabolic risk factors in adolescent girls with type 1 diabetes. J Pediatr Endocrinol Metab 2018; 31(6): 631-635.
- Tell S, Nadeau KJ, Eckel RH. Lipid management for cardiovascular risk reduction in type 1 diabetes. Curr Opin Endocrinol Diabetes Obes 2020; 27(4): 207-21.
- Kim G, Divers J, Fino NF, et al. Trends in prevalence of cardiovascular risk factors from 2002 to 2012 among youth early in the course of type 1 and type 2 diabetes. The SEARCH for Diabetes in Youth Study. Pediatr Diabetes 2019; 20(6): 693-700.
- Rawshani A, Rawshani Araz, Franzén S, et al. Range of Risk Factor Levels: Control, Mortality, and Cardiovascular Outcomes in Type 1 Diabetes Mellitus. Circulation 2017; 135(16): 1522-1531.
- Bode BW, Garg SK. The emerging role of adjunctive noninsulin antihyperglycemic therapy in the management of type 1 diabetes. Endocr Pract 2016; 22(2): 220-230.
- Snaith JR, Holmes-Walker DJ, Greenfield JR. Reducing Type 1 Diabetes Mortality: Role for Adjunctive Therapies? Trends Endocrinol Metab. 2020; 31(2): 150-164.
- Cai X, Lin C, Yang W, Nie L, Ji L. Non-Insulin Antidiabetes Treatment in Type 1 Diabetes Mellitus: A Systematic Review and Meta-Analysis. Diabetes Metab 2021; 45(3): 312-325.
- Rosenstock J, Marquard J, Laffel LM, et al. Empagliflozin as adjunctive to insulin therapy intype 1 diabetes: the EASE trials. Diabetes Care 2018; 41: 2560–2569.
- Dandona P, Mathieu C, Phillip M, et al.; DEPICT-1 Investigators. Efficacy and safety of dapagliflozin in patients with inadequately controlled type 1 diabetes (DEPICT-1): 24 week results from a multicentre, double-blind, phase 3, randomised controlled trial. Lancet Diabetes Endocrinol 2017; 5: 864–876.
- Ahmed-Sarwar N, Nagel AK, Leistman S. SGLT-2 Inhibitors: Is There a Role in Type 1 Diabetes Mellitus Management? Annals of Pharmacotherapy 2017; 51(9): 791-796.
- Danne T, Garg S, Peters AL et al. International Consensus on Risk Management of Diabetic Ketoacidosis in Patients With Type 1 Diabetes Treated With Sodium-Glucose Cotransporter (SGLT) Inhibitors. Diabetes Care 2019; 42(6): 1147-1154.
- Meng H, Zhang A, Liang Y,Hao J, Zhang X, Lu J. Effect of metformin on glycaemic control inpatients with type 1 diabetes: a meta-analysis ofrandomized controlled trials. Diabetes MetabRes Rev 2018; 34: e2983.
- Petrie JR, Chaturvedi N, Ford I, et al.; REMOVAL Study Group. Cardiovascular and meta-bolic effects of metformin in patients with type 1diabetes (REMOVAL): a double-blind, rando-mised, placebo-controlled trial. Lancet Diabe-tes Endocrinol 2017; 5: 597-609.
- Edelman S, Garg S, Frias J, et al. A double-blind, placebo-controlled trial assessing pramlin-tide treatment in the setting of intensive insulintherapy in type 1 diabetes. Diabetes Care 2006; 29: 2189-2195.
- Wang W, Liu H, Xiao S, Liu S, Li X, Yu P. Effects of insulin plus glucagon-like peptide-1 receptor agonists (GLP-1RAs) in treating type 1 diabetes mellitus: a systematic review and meta-analysis. Diabetes Ther 2017; 8: 727-738.