La diabetes mellitus tipo 1 (DM1) es una enfermedad metabólica causada por la destrucción autoinmunitaria de las células β productoras de insulina. El tratamiento de la DM1 es la administración exógena de insulina, lo que rectifica la hiperglicemia. Tras el descubrimiento de la insulina, hace ahora 102 años, la enfermedad dejó de ser mortal para pasar a crónica. Sin embargo, la calidad de vida de los pacientes (especialmente niños y jóvenes) y sus familias se ve afectada y las complicaciones secundarias agudas y crónicas pueden ser muy serias. Mientras, su incidencia aumenta anualmente.
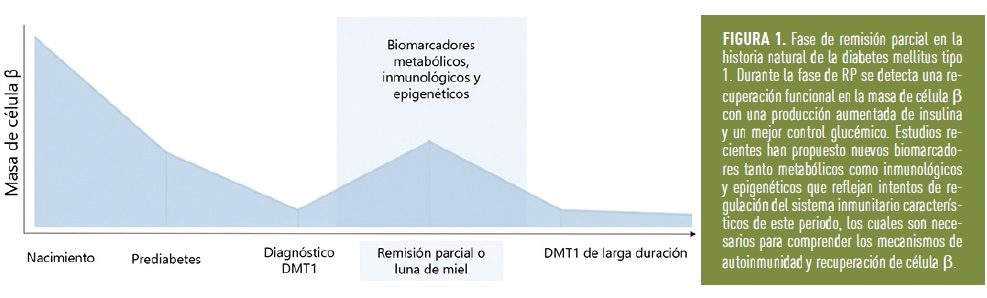
Tras el diagnóstico, los pacientes suelen presentar una remisión parcial (RP) espontánea, coloquialmente llamada “luna de miel” (Figura 1). En la RP mejora el control glucémico y disminuyen los requerimientos de insulina. Esta etapa supone un reposo de las células β remanentes gracias al control de la hiperglucemia con la administración de insulina y a la disminución de la autoinmunidad [1]. La RP ha sido poco estudiada dada su transitoriedad (media de unos 6-7 meses) pero tiene gran interés científico por varios motivos:
- El incremento de insulina endógena durante esta fase está asociado con un menor riesgo de hipoglicemia grave y complicaciones microvasculares.
- Es una etapa candidata para los ensayos clínicos, ya que la inflamación y la autoinmunidad están disminuidas y hay una recuperación parcial de la función de las células β.
- Su caracterización metabólica, inmunológica y genética/epigenética ofrece información relevante para comprender los mecanismos de autoinmunidad y recuperación de célula β.
- Predecir esta fase en el momento del diagnóstico puede contribuir a la estratificación de los pacientes y al mejor seguimiento de estos.
1. Periodo de remisión parcial: cuando la diabetes mellitus tipo 1 parece remitir
La DM1 es una enfermedad multifactorial causada por la destrucción crónica, por causas aún no del todo conocidas, de las células β por parte de unas células del sistema inmunitario, los linfocitos T autoreactivos.
Una de las etapas de la DM1 es la RP o “luna de miel”, fase transitoria que presentan hasta un 80% de los pacientes pocos meses después del inicio de la administración de insulina. Este periodo se caracteriza por niveles persistentes de péptido C, mejor control glicémico y menor prevalencia de complicaciones crónicas a largo plazo. La RP se define según una fórmula de la International Society for Pediatric and Adolescent Diabetes que tiene en cuenta la dosis de insulina diaria y la hemoglobina glicada, siendo un valor <9 indicador de RP [2]. En muy pocos casos, una remisión completa en la que el paciente no necesita insulina puede llegar a ocurrir. En estos casos, además, la RP suele ser más larga llegando hasta los 2 años y medio.
La RP no sólo supone una recuperación metabólica de la masa remanente de células β, sino también una recuperación parcial de la tolerancia inmunológica, es decir, una disminución de la autoinmunidad [3]. Esta inmunoregulación en la RP se refleja en la sangre de los pacientes en forma de alteraciones celulares y moleculares. Estos biomarcadores ofrecen la posibilidad de predecir e identificar esta etapa, así como ofrecer nuevas dianas terapéuticas.
2. ¿Por qué es importante esta etapa?
Al tratarse de una etapa transitoria, las investigaciones que involucran la RP han sido más bien escasas. Sin embargo, desde hace un par de décadas, el interés por la RP ha aumentado y varios grupos de investigación estamos profundizando en los aspectos inmunológicos de esta fase [1,4].
La relevancia científica y médica de la RP es indudable en varios aspectos:
- Se trata de un intento fisiológico de proteger a la célula β, por lo que su caracterización detallada puede identificar nuevas dianas terapéuticas para la DM1.
- Esta etapa tiene gran potencial como periodo óptimo en ensayos clínicos para la curación de la enfermedad, ya sea mediante la aplicación de inmunoterapias (detener la autoinmunidad) como de medicina regenerativa (recuperar la masa de célula β). De hecho, los expertos en inmunoterapias para la DM1 han consensuado la necesidad de tener en cuenta las diferentes etapas de la enfermedad (autoinmunidad, metabolismo, masa de célula β) y seleccionar la más apropiada para las intervenciones terapéuticas, consiguiendo así grupos homogéneos y de mayor éxito en los ensayos clínicos.
- El poder predecir la RP justo en el diagnóstico de la DM1 identificaría a los pacientes que no experimentarán esta etapa, lo que puede facilitar su seguimiento para limitar la disglicemia y reducir la prevalencia de las complicaciones secundarias a largo plazo.
3. Qué nos dicen los biomarcadores de la remisión parcial
El metabolismo de la glucosa es crucial para la homeostasis del sistema inmunitario. Tras el diagnóstico, la rectificación de la hiperglicemia afecta tanto al sistema inmunitario como a las células β que quedan. Aunque el mecanismo de acción no está totalmente caracterizado, el reposo de la célula β induciría una bajada de la intensidad de la autoinmunidad que se refleja en sangre periférica [3,5].
En los últimos años, nuestro grupo ha caracterizado cambios a nivel inmunológico, metabólico y epigenético específicos de la fase de RP para entender qué mecanismos gobiernan esta fase. A nivel de subconjuntos de células inmunitarias, se han observado cambios en linfocitos T efectores y reguladores, equilibrio entre los cuales es necesario para mantener la correcta funcionalidad del sistema inmunitario. Diferentes estudios coinciden en encontrar un mayor número de linfocitos T reguladores en el momento del diagnóstico de la DM1 o durante el período de prediabetes en comparación con los controles sin diabetes, lo que puede reflejar su funcionalidad deteriorada en el contexto de la hiperglucemia y la necesidad de generar constantemente nuevas células para hacer frente al ataque autoinmunitario. En cambio, durante la fase de RP el porcentaje de linfocitos T reguladores es menor en comparación con los pacientes sin remisión, aunque estas células presentan un fenotipo de activación. Estos hallazgos pueden reflejar la funcionalidad recuperada y la reducción en su número después de la rápida rectificación de la hiperglucemia, lo que permite una mayor actividad en el órgano diana y en los órganos linfoides secundarios. Junto con estos resultados, se ha encontrado en periferia un aumento de linfocitos T de memoria efectores, incluyendo los fenotipos Th1, Th17 y citotóxicos [5,6]. Teniendo en cuenta que los linfocitos dentro de los islotes muestran un fenotipo de memoria, su mayor porcentaje en periferia durante la RP podría reflejar la menor migración al órgano diana. Otras células del sistema inmunitario también están alteradas durante esta fase. Por ejemplo, se ha descrito un aumento de células “natural killer” reguladoras, linfocitos B reguladores y B transicionales, pudiendo reflejar estos intentos de inmunoregulación [6,7].
Pero no solo la cantidad de ciertos tipos celulares nos revela mecanismos inmunológicos detrás de esta fase, también las moléculas que expresan en su superficie son un reflejo de su estado de activación y funcionalidad. Por ejemplo, el eje PD-1/PD-L1 es un punto de control inmunitario importante para frenar las respuestas autoinmunitarias. Los pacientes en RP muestran un mayor porcentaje de linfocitos T en sangre positivos tanto para PD-1 como para PD-L1, recuperando así los bajos niveles alcanzados durante el diagnóstico de la enfermedad. Estos cambios, sin embargo, no se observan en pacientes que no experimentan esta fase [8]. En relación con esta molécula, un estudio reciente ha asociado la recuperación de PD-1 en los linfocitos T con el metabolismo celular. Y es que, es concebible que la reducción del ambiente glucotóxico durante la RP tenga un impacto en la función de estas células. Así, se ha descrito que los linfocitos T muestran una disminución de la captación de glucosa durante la fase de remisión en comparación con el momento del diagnóstico, alcanzando los valores presentados por los controles sin diabetes. Además, al final de esta fase, la absorción de glucosa aumenta nuevamente. Sin embargo, estas fluctuaciones en el metabolismo no se detectaron en los pacientes no remitentes, en los que parece haber un aumento en la absorción de glucosa durante los primeros 12 meses después del diagnóstico. Además, existe una correlación negativa entre la expresión de PD-1 y la captación de glucosa en linfocitos T [9].
Las diferentes células del sistema inmunitario también secretan citoquinas, las cuales orquestan múltiples interacciones entre células β y células inmunitarias, y pueden servir como biomarcadores que reflejan el estado inflamatorio del paciente. Nuestro grupo encontró una tendencia a presentar menores niveles de IL-17A y TGF-β durante la fase de RP [6]. Sin embargo, no existe una correlación evidente entre la disminución de los niveles plasmáticos de citoquinas y/o quimiocinas y la RP, por lo que se necesita más investigación para dilucidar su función precisa como biomarcador.
Finalmente, también hemos estudiado el perfil diferencial de microARNs (miRNAs) durante esta fase. Los miRNAs son una familia de ARN pequeño no codificante que regula negativamente la expresión génica a nivel postranscripcional, afectando a muchos procesos celulares como la regulación del sistema inmunitario, apoptosis, metabolismo o la diferenciación y proliferación celular. En comparación con los no remitentes, los pacientes en remisión presentan una expresión diferencial de 16 miRNAs, entre los cuales, el más diferencialmente expresado es el miR-30d-5p. Este miRNA está involucrado en procesos biológicos relacionados con el sistema inmunitario, respuesta al estrés, metabolismo de la insulina o muerte celular. Además, presenta un gran número de genes diana relacionados con el sistema inmunitario, más concretamente con la activación de los linfocitos T. Así, utilizando el modelo de ratón espontáneo para la DM1, el ratón obeso no diabético, abordamos su papel en la regulación del sistema inmunitario. Los resultados muestran una nueva función inmunoreguladora de este miRNA, capaz de afectar a la molécula PD-1 (aumentándola) o a los niveles de linfocitos T reguladores (disminuyéndolos), tal y como se ha observado en sangre periférica durante la RP en pacientes pediátricos con DM1 [10].
En definitiva, la comprensión de los mecanismos inmunológicos, metabólicos y epigenéticos detrás de la RP o los episodios completos de remisión es clave para elucidar la progresión natural de la DM1 y encontrar posibles dianas terapéuticas que nos ayuden a alargar al máximo esta fase, o incluso poder llegar a inducirla.
4. ¿Podemos predecir el periodo de remisión parcial en el momento del diagnóstico de la enfermedad?
Teniendo en cuenta la heterogeneidad dentro de la enfermedad, la estratificación del paciente basada en la presencia o ausencia de remisión no solo puede mejorar su selección en ensayos clínicos, sino también permitir un enfoque terapéutico más personalizado.
La predicción de la RP en el momento del diagnóstico de la DM1 dividiría a los pacientes en dos grupos en función de si desarrollarán o no esta fase. Esta información puede contribuir a la monitorización del paciente, a reducir las complicaciones crónicas y a aplicar una modulación terapéutica para mejorar la progresión. El riesgo de no presentar RP correlaciona con el género femenino, edad menor a 5 años, niveles de bicarbonato <15 mg/dl, positividad para más de 3 autoanticuerpos e índice de masa corporal bajo en el momento del diagnóstico [11].
Sin embargo, existen pocos estudios que analicen la capacidad predictora de la remisión de ciertos parámetros inmunológicos. Por ejemplo, niveles elevados de ciertas citoquinas como la IL-10 o el mayor porcentaje de ciertos tipos celulares como los linfocitos T CD4+CD25+CD127+ también se asocian con el evento de remisión futura [12]. Recientemente, nuestro grupo ha identificado potenciales predictores inmunológicos de la etapa de RP, implicados en el ataque autoinmunitario a la célula β. En base a estos datos se ha creado un modelo predictivo que permite clasificar correctamente a futuros remitentes y no remitentes, teniendo en cuenta a la vez edad, sexo e índice de masa corporal [6]. Aunque son resultados preliminares prometedores, es necesario seguir generando estudios de predicción utilizando grandes cohortes de pacientes que se puedan extrapolar a la práctica clínica.
5. Vamos al grano. ¿Qué utilidad va a tener el estudio de esta etapa?
En las últimas décadas, se han llevado a cabo ensayos clínicos con inmunoterapias para prevenir o curar la DM1. Los objetivos de las inmunoterapias en DM1 han sido detener la autoinmunidad, preservar las células β residuales y curar la enfermedad. Aunque en algunos casos se ha conseguido recuperar parcialmente la función de las células β, los resultados han sido decepcionantes. No obstante, se han podido obtener conclusiones e identificar limitaciones útiles para mejorar las nuevas terapias.
Actualmente, hay muchas inmunoterapias innovadoras y prometedoras en fase de desarrollo. Los expertos coinciden en que hay que diseñar terapias combinadas, frenando el ataque autoinmunitario de manera definitiva (sin afectar el buen funcionamiento del sistema inmunitario) y recuperando la función de las células β. Para lograrlo, hay que trabajar con protocolos rigurosos y estandarizados, grupos homogéneos de pacientes, y utilizar biomarcadores que nos indiquen tanto el estado del sistema inmunitario como el metabólico del paciente en cada momento. En este sentido, la RP parece ser una etapa óptima.
Sin embargo, quedan aún muchas preguntas en el aire respecto a esta etapa:
- Tras el periodo de RP, ¿hay otros episodios de remisión de menor intensidad que pasan desapercibidos? De ser así, estos episodios podrían ser etapas adicionales en las personas con DM1 de larga evolución para aplicar las futuras inmunoterapias o estrategias de medicina regenerativa con mejor pronóstico.
- ¿Qué les ocurre a las células β durante el periodo de RP? Sabemos que mejoran su función metabólica, pero ¿aparecen nuevas células β capaces de producir insulina debido a mecanismos de regeneración?
- ¿Qué cambios se dan en los islotes pancreáticos durante la RP a nivel de células autoinmunitarias? ¿Disminuye la inflamación y la infiltración?
La respuesta a todas estas preguntas permitirá conocer mejor esta etapa y poder utilizarla a nivel clínico.
6. Conclusiones
La etapa de RP en DM1 es esperanzadora por sí misma, ya que nos demuestra que hay intentos del propio paciente para frenar la respuesta autoreactiva y mejorar el control metabólico. De su completa caracterización pueden surgir ideas para nuevas terapias tanto preventivas como curativas que den lugar a nuevas líneas de investigación. Con todo, además, nos puede servir en un futuro para mejorar los resultados de los nuevos ensayos clínicos y encontrar una cura definitiva para la diabetes mellitus tipo 1.
REFERENCIAS
- Fonolleda M, Murillo M, Vázquez F, Bel J, Vives-Pi M. Remission Phase in Paediatric Type 1 Diabetes: New Understanding and Emerging Biomarkers. Horm Res Paediatr. 2017;88(5):307-315. doi:10.1159/000479030
- Mayer-Davis EJ, Kahkoska AR, Jefferies C, et al. ISPAD Clinical Practice Consensus Guidelines 2018: Definition, epidemiology, and classification of diabetes in children and adolescents. Pediatr Diabetes. 2018;19:7-19. doi:10.1111/PEDI.12773
- Tang R, Zhong T, Wu C, Zhou Z, Li X. The Remission Phase in Type 1 Diabetes: Role of Hyperglycemia Rectification in Immune Modulation. Front Endocrinol (Lausanne). 2019;10. doi:10.3389/fendo.2019.00824
- Zhong T, Tang R, Gong S, Li J, Li X, Zhou Z. The remission phase in type 1 diabetes: Changing epidemiology, definitions, and emerging immuno‐metabolic mechanisms. Diabetes Metab Res Rev. 2020;36(2). doi:10.1002/dmrr.3207
- Fitas AL, Martins C, Borrego LM, et al. Immune cell and cytokine patterns in children with type 1 diabetes mellitus undergoing a remission phase: A longitudinal study. Pediatr Diabetes. 2018;19(5):963-971. doi:10.1111/pedi.12671
- Gomez-Muñoz L, Perna-Barrull D, Caroz-Armayones JM, et al. Candidate Biomarkers for the Prediction and Monitoring of Partial Remission in Pediatric Type 1 Diabetes. Front Immunol. 2022;13. doi:10.3389/fimmu.2022.825426
- Gomez-Muñoz L, Perna-Barrull D, Villalba A, et al. NK Cell Subsets Changes in Partial Remission and Early Stages of Pediatric Type 1 Diabetes. Front Immunol. 2021;11. doi:10.3389/FIMMU.2020.611522
- Li X, Zhong T, Tang R, et al. PD-1 and PD-L1 Expression in Peripheral CD4/CD8+ T Cells Is Restored in the Partial Remission Phase in Type 1 Diabetes. J Clin Endocrinol Metab. 2020;105(6):1947-1956. doi:10.1210/clinem/dgaa130
- Tang R, Zhong T, Lei K, Lin X, Li X. Recovery of intracellular glucose uptake in T cells during partial remission of type 1 diabetes. Diabetologia. 2023;66(8):1532-1543. doi:10.1007/S00125-023-05938-Z/METRICS
- Gómez-Muñoz L, Perna-Barrull D, Murillo M, et al. Immunoregulatory Biomarkers of the Remission Phase in Type 1 Diabetes: miR-30d-5p Modulates PD-1 Expression and Regulatory T Cell Expansion. Noncoding RNA. 2023;9(2):17. doi:10.3390/NCRNA9020017/S1
- Marino KR, Lundberg RL, Jasrotia A, et al. A predictive model for lack of partial clinical remission in new-onset pediatric type 1 diabetes. Pietropaolo M, ed. PLoS One. 2017;12(5):e0176860. doi:10.1371/journal.pone.0176860
- Narsale A, Lam B, Moya R, et al. CD4+CD25+CD127hi cell frequency predicts disease progression in type 1 diabetes. JCI Insight. 2021;6(2). doi:10.1172/jci.insight.136114







