Proyecto financiado por la Fundación La Caixa y el Consejo Europeo de Investigación (ERC).
Entender cómo un grupo de pequeños fragmentos génicos recientemente identificado en islotes pancreáticos regula el desarrollo y función secretora de las células beta podría abrir nuevas puertas para entender mejor los mecanismos celulares alterados en diabetes y para el desarrollo de nuevos fármacos.
El splicing alternativo: ¿cuántas caras tiene un gen?
El Proyecto Genoma Humano reveló que nuestro genoma contiene alrededor de 20.000 genes que codifican para proteínas; algo sorprendente si tenemos en cuenta que organismos biológicamente menos complejos como, por ejemplo, el gusano de tierra (el famoso nematodo C. elegans) tienen un número similar de genes. Una posible explicación para esta aparente paradoja (la falta de correlación entre complejidad biológica y número de genes) es la presencia de múltiples mecanismos moleculares que permiten expandir exponencialmente la información codificante. Es decir, incrementar la capacidad para codificar distintas proteínas a partir de un número fijo de genes en el genoma. Uno de los mecanismos más importantes es el splicing alternativo del ARN, un proceso que permite a un único gen generar múltiples proteínas con propiedades o funciones diferentes simplemente combinando las piezas de las que están formadas los genes.
Los genes eucariotas están organizados en piezas alternas compuestas por exones, que son las partes codificantes, e intrones, que son no codificantes. Después de la transcripción génica de ADN a ARN, las moléculas de ARN sufren un proceso de corte y empalme en el que los intrones son eliminados y los exones re-ensamblados consecutivamente para formar una cadena madura de ARN mensajero que dará lugar a la proteína. Este es el proceso que conocemos como splicing.
¿Qué ventajas pueden sacar las células a cambio de tener que realizar este costoso e intrincado proceso?
Una ventaja fundamental es que les permite generar multitud de variantes proteicas a partir de un mismo gen. Aunque la mayoría de los exones de un gen acostumbran a ser de uso obligatorio para producir una proteína funcional, otros son optativos o «alternativos», con lo que pueden o no incluirse en la cadena de ARN que posteriormente se utilizará para generar las proteínas. Jugando con los exones que pueden o no incluirse en el tránscrito, las células pueden generar infinidad de combinaciones de ARN y producir así proteínas con secuencias aminoacídicas diferentes. Estas variantes proteicas generadas a partir del mismo gen a menudo presentan importantes diferencias entre sí, tanto a nivel de propiedades bioquímicas como de su papel en la biología celular. Este proceso especial de splicing se conoce como «splicing alternativo”, y entender cómo las células del páncreas, en concreto, usan este proceso y qué puede ocurrir cuando no funciona bien, es uno de los principales objetivos de nuestra investigación.
Impacto del splicing alternativo sobre la función celular
Multitud de estudios publicados durante los últimos años han demostrado que el splicing alternativo ocurre en la mayoría de los genes humanos y juega un papel esencial en infinidad de procesos biológicos (1). Sabemos que contribuye al desarrollo embrionario y fisiología de los tejidos y que está implicado en múltiples patologías tales como cardiopatías, distrofias musculares, trastornos neuropsiquiátricos o cáncer (2). Además, se estima que un tercio de las mutaciones patológicas afectan al patrón de splicing de los genes en que se encuentran.
Una peculiaridad de una parte sustancial del splicing alternativo es que se produce sólo en tipos celulares o tejidos concretos y está a menudo asociado a alguna de las funciones especializadas de estas células. Tal es el caso del sistema nervioso, que presenta las proporciones más altas de splicing alternativo propio, contribuyendo así a la complejidad celular y funcional del cerebro. En muchos casos, este tipo de splicing alternativo específico de un tejido concreto se genera porque depende de unas pocas proteínas que controlan el proceso (llamados «factores de splicing» o «reguladores de splicing”) que sólo se producen en ese tejido. Estos reguladores funcionan de un modo muy sencillo: imaginemos unas luces de navidad que se encienden al apretar el interruptor. Ese interruptor sería el regulador y las luces los exones alternativos que controla. Sin activar el interruptor (el regulador), los exones no aparecerán en los ARNs maduros de sus respectivos genes. Al activarlo, todos esos exones se encenderán y formarán parte de las proteínas que se generen en las células que tengan el regulador activado (ej. las neuronas).
Un ejemplo paradigmático de splicing específico de un tipo celular concreto son los microexones. Como su nombre indica, éstos son exones alternativos (es decir, secuencias que pueden incluirse o no en el ARN) extremadamente pequeños. Si un exón medio tiene 150 nucleótidos (las letras que componen la información genética), los microexones tienen entre 3 y 27 letras. Si los comparamos con las palabras de un texto, serían palabras como «y», «no», etc. Y, como en esos ejemplos, esas palabras pueden tener gran relevancia para el significado de una frase (el ARN y la proteína).
EL PROYECTO GENOMA HUMANO REVELÓ QUE NUESTRO GENOMA CONTIENE ALREDEDOR DE 20.000 GENES QUE CODIFICAN PARA PROTEÍNAS; ALGO SORPRENDENTE SI TENEMOS EN CUENTA QUE ORGANISMOS BIOLÓGICAMENTE MENOS COMPLEJOS COMO, POR EJEMPLO, EL GUSANO DE TIERRA (EL FAMOSO NEMATODO C. ELEGANS) TIENEN UN NÚMERO SIMILAR DE GENES
¿Qué más características hacen a los microexones especiales, además de su tamaño?
Una de las más importantes es que, cuando los descubrimos, la mayoría solo aparecían en las neuronas (3). Y esto era debido a que en las neuronas hay un par de interruptores que están activos solo en este tipo celular: los genes SRRM3 y SRRM4. Además, las partes de las proteínas a las que afectan los microexones son a menudo las partes funcionales de éstas. Asimismo, cuando estudiamos su evolución, vimos que la mayoría de los microexones están también presentes en peces y tiburones, es decir, mantenidos por selección natural por cientos de millones de años. Estos datos, junto con otras peculiaridades, sugieren que los microexones tienen vital importancia biológica. Consecuentemente, muchos estudios experimentales posteriores han demostrado que una mala regulación de los microexones (por la incorrecta activación de SRRM3 y/o SRRM4) en ratones provoca alteraciones neuronales severas, tales como defectos en el desarrollo neuronal, la estratificación del córtex cerebral o la transmisión sináptica (4, 5). Asimismo, se ha observado que las personas con trastornos del espectro autista presentan a menudo alteraciones en la expresión de SRRM4 y en la inclusión de los microexones en el cerebro. Varios modelos de ratón han demostrado que la alteración de SRRM4 (6) o, incluso, la ausencia de un solo microexon (7), son suficientes para recapitular numerosas características clínicas del autismo, apoyando así la implicación de los microexones en la fisiopatología de este trastorno.
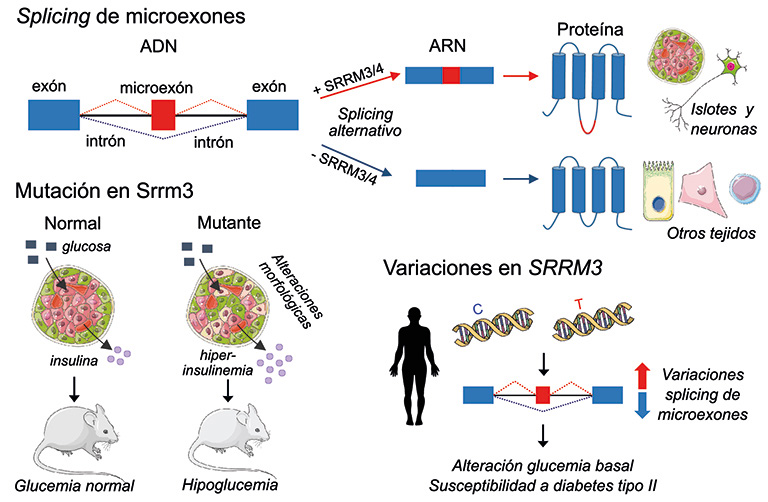
Los microexones y el splicing alternativo en islotes pancreáticos
El splicing alternativo en islotes pancreáticos ha sido mucho menos estudiado en comparación con otros tejidos. No obstante, estudios recientes han revelado que las células endocrinas del páncreas producen ciertos reguladores de splicing previamente identificados solamente en neuronas (8), y ambos tejidos comparten un gran número de exones alternativos que no se incluyen en otros tipos celulares o tejidos (9). Este hecho puede parecer sorprendente, considerando que neuronas y células pancreáticas tienen distinto origen embriológico. Sin embargo, sabemos que neuronas y células endocrinas comparten múltiples similitudes que van desde una regulación genómica parecida hasta una fisiología análoga (10). De hecho, las células beta liberan insulina usando una maquinaria secretora que en muchos aspectos se asemeja a la usada en neuronas para la liberación de neurotransmisores. Las neuronas son evolutivamente más antiguas que las células endocrinas pancreáticas, y en muchos invertebrados son neuronas las células que producen insulina y regulan los niveles circulantes de glucosa. Todo esto sugiere que las células de los islotes evolucionaron a células especializadas en la secreción hormonal en parte gracias a la asimilación de programas genéticos neuronales.
SE HA OBSERVADO QUE LAS PERSONAS CON TRASTORNOS DEL ESPECTRO AUTISTA PRESENTAN A MENUDO ALTERACIONES EN LA EXPRESIÓN DE SRRM4 Y EN LA INCLUSIÓN DE LOS MICROEXONES EN EL CEREBRO
En línea con esta hipótesis, nuestro grupo ha descubierto que casi la mitad de los microexones que se consideraban exclusivos de las neuronas también están presentes en los islotes (9). En concreto, se han descrito unos 250 microexones en neuronas, mientras que en islotes hay algo más de 100 de esos 250. Y esto es gracias a que los islotes también expresan SRRM3, el interruptor de los microexones neuronales, aunque a menor nivel. Curiosamente, estos microexones compartidos se encuentran en muchos casos en genes implicados tanto en la secreción de insulina (en islotes) como de neurotransmisores (en neuronas), sugiriendo que están generando proteínas especialmente optimizadas para esas funciones secretoras complejas compartidas. Además, varios de estos genes con microexones en los islotes habían sido previamente asociados al riesgo de padecer diabetes, lo que sugiere en su conjunto que tienen un papel relevante en células beta y en el metabolismo de la glucosa.
En concordancia con esta hipótesis, la deleción de SRRM3 o la manipulación del splicing de algunos microexones individuamente altera la secreción de insulina tanto en líneas de célula beta humanas como en islotes primarios de ratón (9). Además, ratones portadores de mutaciones en SRRM3 presentan alteraciones en el desarrollo y función de los islotes (9). Estos ratones presentan alteraciones en la arquitectura y composición celular de los islotes, con un aumento de células alfa y de células beta inmaduras. Asimismo, las células beta de estos ratones presentan una secreción de insulina en respuesta a niveles altos de glucosa y aminoácidos anómalamente alta. Conjuntamente, estos defectos provocan que estos ratones presenten un mal control glucémico, caracterizado por niveles constantemente elevados de insulina en sangre e hipoglucemia persistente, en línea con un trastorno metabólico relativamente raro conocido como hiperinsulinemia congénita.
Aunque hasta el momento no se han identificado mutaciones en SRRM3 asociadas a hiperinsulinemia congénita en humanos, múltiples evidencias sugieren que los microexones podrían tener un papel relevante en el metabolismo de la glucosa y en la patofisiología de la diabetes (9). Por un lado, hemos identificado variantes genéticas en SRRM3 asociadas a niveles altos de glucosa en sangre y riesgo de padecer diabetes. Y, por otro lado, hemos observado que los islotes de pacientes con diabetes presentan una reducción generalizada de la inclusión de microexones.
En conjunto, estos datos sugieren que los cambios en la actividad del programa pancreático de microexones podrían afectar a la función de los islotes y al correcto control glucémico, contribuyendo así a la predisposición a padecer diabetes.
LAS VARIANTES DE SPLICING ESPECÍFICAS DE CÉLULA BETA, DETECTADAS YA SEA EN SUERO O MEDIANTE TÉCNICAS NO INVASIVAS DE IMAGEN, PODRÍAN CONSTITUIR BIOMARCADORES IDEALES PARA MONITORIZAR LAS CÉLULAS BETA DURANTE LA PROGRESIÓN DE LA DIABETES DE TIPO 1
Manipulación del splicing alternativo con fines terapéuticos
Aunque queda un largo camino para entender como el splicing alternativo, y en concreto los microexones, afectan funciones moleculares y celulares básicas para la célula beta y el control glucémico, el estudio del splicing alternativo podría abrir nuevas puertas en el campo de la diabetes. Actualmente existe un amplio abanico de estrategias para manipular el splicing con fines terapéuticos para multitud de patologías humanas, y algunas de ellas ya disponen de fármacos moduladores de splicing aprobados para uso clínico.
Los microexones, al tener una alta especificidad en islotes y un rol relevante en la secreción de insulina, podrían representar una diana terapéutica para tratar la disfuncionalidad de las células beta que ocurre en la diabetes de tipo 2.
Por otro lado, la especificidad tisular del splicing alternativo también podría ser explotada con finalidades diagnósticas. En la diabetes de tipo 1, las células beta son atacadas y destruidas por el sistema inmune. Con el fin de identificar terapias eficaces en el control del ataque inmune, es crucial identificar biomarcadores que reflejen el estado o pérdida de células beta. Las variantes de splicing específicas de célula beta, detectadas ya sea en suero o mediante técnicas no invasivas de imagen, podrían constituir biomarcadores ideales para monitorizar las células beta durante la progresión de la diabetes de tipo 1.
Bibliografía
- Baralle, F. E. & Giudice, J. Alternative splicing as a regulator of development and tissue identity. Nat. Rev. Mol. Cell Biol. 18, 437-451 (2017).
- Daguenet, E., Dujardin, G. & Valcarcel, J. The pathogenicity of splicing defects: mechanistic insights into pre-mRNA processing inform novel therapeutic approaches. EMBO Rep. 16, 1640-1655 (2015).
- Irimia, M. et al. A highly conserved program of neuronal microexons is misregulated in autistic brains. Cell 159, 1511-1523 (2014).
- Quesnel-Vallieres, M., Irimia, M., Cordes, S. P. & Blencowe, B. J. Essential roles for the splicing regulator nSR100/SRRM4 during nervous system development. Genes Dev. 29, 746-759 (2015).
- Nakano, Y., Wiechert, S. & Banfi, B. Overlapping Activities of Two Neuronal Splicing Factors Switch the GABA Effect from Excitatory to Inhibitory by Regulating REST. Cell. Rep. 27, 860-871.e8 (2019).
- Quesnel-Vallieres, M. et al. Misregulation of an Activity-Dependent Splicing Network as a Common Mechanism Underlying Autism Spectrum Disorders. Mol. Cell 64, 1023-1034 (2016).
- Parras, A. et al. Autism-like phenotype and risk gene mRNA deadenylation by CPEB4 mis-splicing. Nature 560, 441-446 (2018).
- Juan-Mateu, J. et al. Neuron-enriched RNA-binding Proteins Regulate Pancreatic Beta Cell Function and Survival. J. Biol. Chem. 292, 3466-3480 (2017).
- Juan-Mateu, J. et al. Control of pancreatic islet function and glucose homeostasis by a novel microexon program misregulated in type 2 diabetes. bioRxiv (2022).
- Arntfield, M. E. & van der Kooy, D. beta-Cell evolution: How the pancreas borrowed from the brain: The shared toolbox of genes expressed by neural and pancreatic endocrine cells may reflect their evolutionary relationship. Bioessays 33, 582-587 (2011).







