El síndrome del ovario poliquístico (SOP) es una patología de índole endocrino-reproductivo, cuya prevalencia ronda del 7 al 13% de las mujeres en edad fértil en diferentes poblaciones a nivel mundial (1), cifras pandémicas similares a entidades como la diabetes mellitus tipo 2. Las repercusiones más reconocidas en las mujeres que lo padecen son por un lado aquellas que afectan a la esfera dermo-cosmética como consecuencia de la elevación de andrógenos circulantes con un incremento de pelo terminal en zonas dependientes de andrógenos (hirsutismo), aparición de acné más allá de la segunda década de la vida, y/o alopecia, y que acarrean un importante impacto psicoemocional en las pacientes, y por otro lado, los problemas de índole reproductivo, bien subfertilidad, bien incremento del riesgo de hiperplasia endometrial/adenocarcinoma de endometrio en mujeres con disfunción ovulatoria grave (2).
No obstante, no menos importante, las pacientes aquejadas de esta condición asocian alteraciones metabólicas que las colocan en una posición de incremento del riesgo cardiovascular (3). En la fisiopatogenia de este riesgo cardiometabólico subyace un defecto en la esteroidogénesis ovárica y suprarrenal de etiología compleja, con un incremento de la síntesis de andrógenos que favorece el depósito adiposo disfuncional de tipo visceral, y que a su vez, en un círculo vicioso, facilita de forma directa el hiperandrogenismo al desencadenar un estado proinflammatorio crónico y promover el estrés oxidativo, o de manera indirecta mediante la inducción de resistencia a la acción de la insulina e hiperinsulinismo, ya que la propia insulina actúa como un factor estimulador de la síntesis de andrógenos en el ovario y glándula suprarrenal (2). Tampoco se debe olvidar, que los factores ambientales juegan también un importante papel en su desarrollo. En el caso del SOP, el más determinante es el incremento de la adiposidad de origen exógeno, consecuencia de una ingesta hipercalórica y/o sedentarismo, que desenmascara en muchas pacientes esta alteración primaria de la síntesis androgénica.
En definitiva, el SOP constituye un paradigma de enfermedad endocrino-metabólica, y tiene una estrecha relación con las alteraciones del metabolismo de los hidratos de carbono (4). La resistencia a la acción de la insulina a nivel hepático está presente en la mayoría de las mujeres con el fenotipo hiperandrogénico de SOP (5), modulando la presencia de obesidad la afectación a nivel periférico. Esta resistencia a la acción de la insulina, al menos en un subgrupo de mujeres con SOP, es consecuencia de un defecto en la señalización post-receptor de insulina como se ha demostrado en el tejido adiposo de estas mujeres (6), aunque factores descritos previamente, como la inflamación crónica y estrés oxidativo, juegan también un papel clave. Sin embargo, el desarrollo de alteraciones del metabolismo de los hidratos de carbono en estas pacientes requiere de un fallo progresivo de la célula pancreática, y por lo tanto, la pérdida de equilibrio entre secreción de insulina y resistencia a la acción de la misma. Dicha pérdida de función presenta agregación familiar ya que es más frecuente en aquellas mujeres con antecedentes de diabetes mellitus.
Con este sustrato fisiopatogénico, no es sorprendente que hasta un 25% de mujeres premenopáusicas con SOP presenten alteraciones del metabolismo de los hidratos de carbono (7), que incluyen el desarrollo de prediabetes, diabetes mellitus tipo 2 y diabetes gestacional. Así, el diagnóstico de SOP en una mujer premenopáusica incrementa 2 veces y media el riesgo de presentar intolerancia a los hidratos de carbono, multiplica por 4 las posibilidades de padecer diabetes mellitus tipo 2, y prácticamente por 3 los diagnósticos de síndrome metabólico, cuando estas pacientes se comparan con mujeres sin hiperandrogenismo de similar índice de masa corporal (8). De igual forma, las mujeres con SOP en comparación con gestantes sin hiperandrogenismo funcional presentan un riesgo 2 veces superior de desarrollar diabetes gestacional, incluso después de ajustar por múltiples factores de confusión incluyendo la presencia de alteraciones del metabolismo de carbono pregestacionales (9).
Despistaje de las alteraciones hidrocarbonadas en mujeres con SOP
En consonancia con estas evidencias, el despistaje de dichas alteraciones debe ofrecerse a todas las mujeres asintomáticas con SOP no gestantes, y en aquellas embarazadas, precozmente durante la gestación (7, 10).
El diagnóstico de prediabetes/diabetes en el SOP presenta dos peculiaridades respecto a las recomendaciones en la población general.
- En primer lugar, de acuerdo a datos propios en nuestro medio (7), y apoyados por hallazgos obtenidos en otras poblaciones, el despistaje o diagnóstico de alteraciones del metabolismo de los hidratos de carbono en mujeres no gestantes, debe basarse en los valores de glucosa plasmática tras sobrecarga oral de glucosa de 75 gramos, puesto que las determinaciones de glucemia venosa en ayunas o hemoglobina glicada son escasamente sensibles para este objetivo, obviando el diagnóstico de prediabetes/diabetes en aproximadamente un 40% de aquellas mujeres que realmente lo presentan (7).
En segundo lugar, merece comentario el despistaje de dichas alteraciones durante la gestación. Puesto que el diagnóstico bioquímico convencional en uno o dos pasos no está estandarizado en el primer trimestre de la gestación, es decir los puntos convencionales de corte diagnóstico derivan de estudios en mujeres en la segunda mitad de su embarazo, en mujeres con menos de 20 semanas de gestación lo que realmente debemos identificar es la presencia de una diabetes mellitus pregestacional inadvertida, por lo que se debería realizar una sobrecarga oral de glucosa de 75 gramos aplicando los mismos criterios diagnósticos que en la población general (7), siempre y cuando la paciente no cuente con un estudio reciente previo a la gestación.. A partir de la segunda mitad del embarazo el protocolo de estudio recomendado es el mismo aplicable al resto de las gestantes de la población general (10).
SOP y diabetes tipo 1
Más desconocido por los profesionales de la salud y las propias pacientes es el incremento de riesgo de SOP que asocian las mujeres con diabetes mellitus tipo 1. Trabajos pioneros en nuestro medio (11), confirmados posteriormente en otras poblaciones, objetivan una prevalencia de SOP en mujeres con diabetes mellitus tipo 1 en torno al 25% (12), así como una fuerte asociación de las características típicas del síndrome con este tipo de diabetes. Pero ¿cuál es el mecanismo fisiopatogénico subyacente en estas mujeres con ausencia de producción, o en cualquier caso marginal, de insulina endógena? En este caso el factor determinante es el hiperinsulinismo exógeno propio del tratamiento intensivo con insulina con ausencia del aclaramiento hepático que se produce en situaciones fisiológicas, y que expone a tejidos periféricos, incluyendo el tejido ovárico y suprarrenal, a concentraciones elevadas de insulina, y por lo tanto, incrementa la actividad de las enzimas implicadas en la síntesis de andrógenos (13). Además de la influencia del SOP sobre aspectos dermatológicos y reproductivos en estas mujeres, el posible impacto sobre el control metabólico y las complicaciones crónicas del exceso androgénico a medio-largo plazo es simplemente desconocido en el momento actual, ante la ausencia de estudios que hayan evaluado este aspecto de la salud de las mujeres con diabetes mellitus tipo 1 (13).
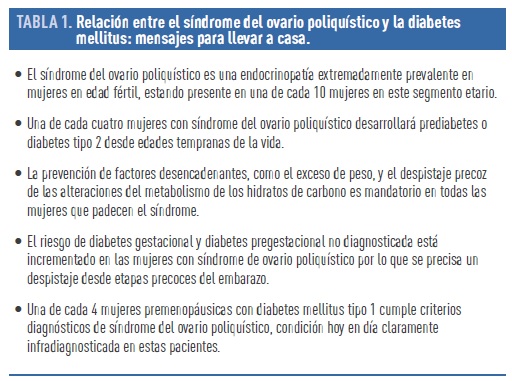
En resumen (Tabla 1), el SOP es la endocrinopatía más frecuente en mujeres en edad fértil a nivel mundial, y su fisiopatogenia comparte nexos comunes con la de las alteraciones del metabolismo de los hidratos de carbono. La propia elevación de andrógenos característica del síndrome favorece un fenotipo dismetabólico propenso al desarrollo de diabetes mellitus tipo 2. Por ello, aunque en ocasiones obviado, el despistaje precoz, prevención y tratamiento de estas alteraciones es mandatorio en todas las mujeres con SOP, especialmente en aquellas con factores de riesgo como el exceso de peso o en situaciones de especial significación como el embarazo. Aunque la relación entre diabetes mellitus tipo 1 y SOP es inequívoca, es necesario un mayor grado de conocimiento y alerta entre los profesionales de la salud acerca de su existencia, ya que la presencia del síndrome en estas mujeres es una comorbilidad añadida cuyo impacto real está aún por desenmascarar.
Referencias
- Bozdag G, Mumusoglu S, Zengin D, Karabulut E, Yildiz BO. The prevalence and phenotypic features of polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod 2016;31:2841-55.
- Escobar-Morreale HF. Polycystic ovary syndrome: definition, aetiology, diagnosis and treatment. Nat Rev Endocrinol 2018;14:270-84.
- Randeva HS, Tan BK, Weickert MO, Lois K, Nestler JE, Sattar N et al. Cardiometabolic aspects of the polycystic ovary syndrome. Endocr Rev 2012;33:812-41.
- Luque-Ramirez M, Escobar-Morreale HF. Polycystic ovary syndrome as a paradigm for prehypertension, prediabetes, and preobesity. Curr Hypertens Rep 2014;16:500.
- Moghetti P, Tosi F, Bonin C, Di Sarra D, Fiers T, Kaufman JM et al. Divergences in insulin resistance between the different phenotypes of the polycystic ovary syndrome. J Clin Endocrinol Metab 2013;98:E628-37.
- Diamanti-Kandarakis E, Dunaif A. Insulin resistance and the polycystic ovary syndrome revisited: an update on mechanisms and implications. Endocr Rev 2012;33:981-1030.
- Ortiz-Flores AE, Luque-Ramírez M, Fernández-Durán E, Alvarez-Blasco F, Escobar-Morreale HF. Diagnosis of disorders of glucose tolerance in women with polycystic ovary syndrome (PCOS) at a tertiary care center: fasting plasma glucose or oral glucose tolerance test? Metabolism 2019;93:86-92.
- Moran LJ, Misso ML, Wild RA, Norman RJ. Impaired glucose tolerance, type 2 diabetes and metabolic syndrome in polycystic ovary syndrome: a systematic review and meta-analysis. Hum Reprod Update 2010;16:347-63.
- Mills G, Badeghiesh A, Suarthana E, Baghlaf H, Dahan MH. Polycystic ovary syndrome as an independent risk factor for gestational diabetes and hypertensive disorders of pregnancy: a population-based study on 9.1 million pregnancies. Hum Reprod 2020;35:1666-74.
- Teede HJ, Misso ML, Costello MF, Dokras A, Laven J, Moran L et al. Recommendations from the international evidence-based guideline for the assessment and management of polycystic ovary syndrome. Hum Reprod 2018;33:1602-18.
- Escobar-Morreale HF, Roldan B, Barrio R, Alonso M, Sancho J, de la Calle H et al. High prevalence of the polycystic ovary syndrome and hirsutism in women with type 1 diabetes mellitus. J Clin Endocrinol Metab 2000;85:4182-7.
- Escobar-Morreale HF, Roldán-Martín MB. Type 1 Diabetes and Polycystic Ovary Syndrome: Systematic Review and Meta-analysis. Diabetes Care 2016;39:639-48.
- Escobar-Morreale HF, Bayona A, Nattero-Chávez L, Luque-Ramírez M. Type 1 diabetes mellitus and polycystic ovary syndrome. Nat Rev Endocrinol 2021;24:021-00576.