El concepto amplio de “esteatosis hepática” engloba varios procesos relacionados con el depósito de grasa en el hígado y reacciones inflamatorias asociadas, que tienen distinto nivel de riesgo de desarrollar complicaciones. Los principales factores de riesgo son la obesidad, la diabetes, especialmente la diabetes tipo 2 (DM2), la dislipidemia, la resistencia a la insulina (RI), la hipertensión y factores genéticos1.
Desde el año 2020, los pacientes con DM2 y/o obesidad o normopeso con dos o más factores de riesgo cardiovascular, la entidad que nos ocupa, pasó a denominarse enfermedad hepática metabólica (EHMet) o metabolic associated fatty liver disease (MAFLD)2.
El hígado graso no alcohólico (non-alcoholic fatty liver disease, NAFLD), es la enfermedad hepática más común en todo el mundo y la principal causa de morbilidad y mortalidad relacionadas con el hígado. Su presencia supone una reducción de tiempo estimado de vida de 4 años. La NAFLD se define por una infiltración grasa del hígado, generalmente, triglicéridos, colesterol y ácidos grasos, que afecta a más del 5% de los hepatocitos, objetivada ya sea por histología hepática o por técnicas de imagen3. Se trata de un diagnóstico excluyente, puesto que para poder diagnosticar a una persona de NAFLD, aparte de este hallazgo, debe descartarse una historia de consumo excesivo de alcohol, definido como ingesta de alcohol > 20 g/día en mujeres y > 30 g/día en hombres; así como otras causas conocidas de enfermedad hepática (hepatitis víricas, etc.)
La MAFLD puede tener consecuencias graves para la salud y está asociada con un mayor riesgo de enfermedad cardiovascular y mortalidad. El aumento de la prevalencia de esta enfermedad, en población general, ha hecho que desde 2015 sea la principal causa de trasplante hepático, al disponer hoy en día de tratamientos eficaces para la hepatitis C.
En nuestro siglo la obesidad y la DM2 han cobrado tintes de verdaderas epidemias, la esteatosis hepática también puede recibir esta calificación, pero con la singularidad de existir un desconocimiento/infradiagnóstico altísimo, tanto por parte de los pacientes, como por los facultativos que les atienden.
EL CONCEPTO AMPLIO DE “ESTEATOSIS HEPÁTICA” ENGLOBA VARIOS PROCESOS RELACIONADOS CON EL DEPÓSITO DE GRASA EN EL HÍGADO Y REACCIONES INFLAMATORIAS ASOCIADAS, QUE TIENEN DISTINTO NIVEL DE RIESGO DE DESARROLLAR COMPLICACIONES
En una revisión sistemática y metanálisis4 con NAFLD en mayores de 18 años, diagnosticada mediante un método de imagen, en ausencia de consumo excesivo de alcohol y hepatitis viral, se estimó que la prevalencia general en todo el mundo era del 32,4% (IC del 95%: 29,9–34,9). Habiendo aumentado esta significativamente con el tiempo en más de un 10% en los últimos 5 años5. La prevalencia global de NAFLD fue significativamente mayor en hombres que en mujeres (39,7% frente a 25,6%).
En pacientes con DM2 estos datos son todavía mayores, así en Europa, la prevalencia de MAFLD llega hasta casi al 70%6.
Sin duda, descartar la presencia de esteatohepatitis no alcohólica (non-alcoholic steatohepatitis, NASH), es el punto más importante en el abordaje de la MAFLD, tanto para el pronóstico como para el tratamiento. La existencia de NASH puede suponer la presencia de fibrosis, en sus diferentes grados, junto con la esteatosis, abombamiento/balonización hepatocelular e inflamación lobulillar.
La importancia de identificar este diagnóstico y actuar según el grado de evolución, va dirigido a revertir la historia natural del proceso, siendo este un continuo, que incluye tanto la acumulación simple de grasa en el hígado (NAFL), como NASH, (con inflamación/fibrosis y daño celular), pudiendo evolucionar a complicaciones más graves como la cirrosis compensada o descompensada. Hoy en día, la NAFLD ha pasado a ser la primera causa de cirrosis, al haber disminuido, por los eficaces tratamientos la hepatitis C; siendo el último estadio de este continuo el hepatocarcinoma. En este continuo evolutivo existen posibilidades de progresión, pero a su vez también de regresión7. (ver figura 1)
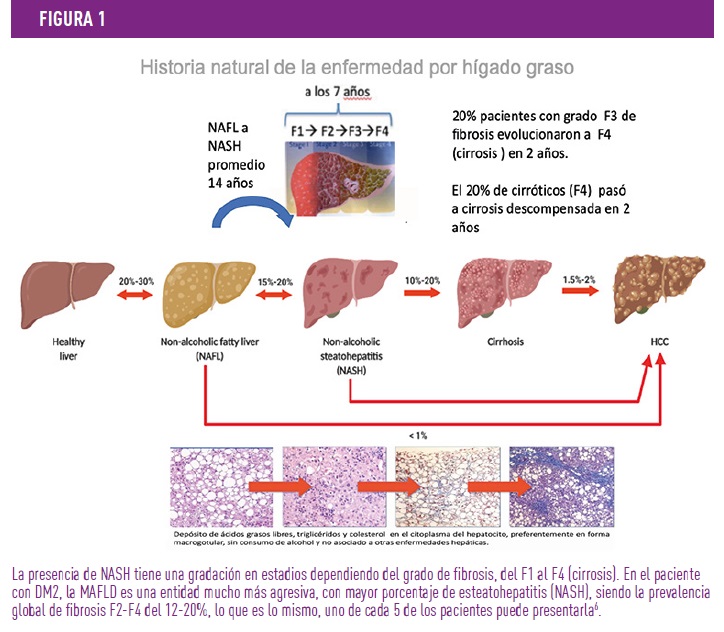
Diagnóstico:
¿Cuáles son las razones que propician la falta de diagnóstico-conocimiento de la presencia de NAFLD?
Sin duda la falta de síntomas en las etapas tempranas es un motivo. Sin embargo, a medida que la enfermedad progresa, pueden aparecer síntomas como fatiga, pérdida de apetito y/o dolor en el hipocondrio derecho, en caso de presencia de cirrosis descompensada puede darse confusión mental.
El diagnóstico de la NAFLD implica la exclusión de otras causas de enfermedad hepática, como el consumo excesivo de alcohol, la hepatitis viral y las enfermedades autoinmunes. Esto se realiza mediante la evaluación de la historia clínica del paciente y pruebas de laboratorio, como son la valoración de la función hepática y pruebas serológicas que excluyan hepatitis viral.
Concomitantemente se utilizan pruebas de imagen para evaluar la presencia y gravedad de la esteatosis hepática. La ecografía es de utilidad para la evaluación inicial de la esteatosis hepática, de fácil disponibilidad. Sin embargo, no permite el diagnóstico en estadios tempranos de la enfermedad, pues precisa de un 12,5% de grasa intrahepática, por lo cual, en caso de ser negativa y tener alta sospecha de enfermedad, se debe complementar la evaluación con otros métodos diagnósticos, siendo útiles tanto el TAC abdominal como la Resonancia Magnética. Ninguno de estos tres métodos informa del grado de fibrosis.
Para el diagnóstico de fibrosis se dispone de la elastografía de transición (Fibroscan), y la elastografía por resonancia magnética (MRE), esta sería el método de elección por su sensibilidad y especificidad, ya que tiene una especificidad del 100% cuando el contenido graso es mayor del 30%, pero su uso no es coste-efectivo. Además de las pruebas de imagen, las pruebas de laboratorio, como la determinación de alanina-aminotransferasa (GOT/AST), aspartato-aminotransferasa (GPT/ALT), albúmina, hemograma, triglicéridos (TG), glucosa, insulina y otras, así como valores antropométricos como el índice de masa corporal (IMC), perímetro de cintura, incluso el género y la edad, nos sirven para el cálculo de índices diagnósticos, tanto de esteatosis (tabla 1), como, lo que es más importante, de fibrosis e inflamación (tabla 2).
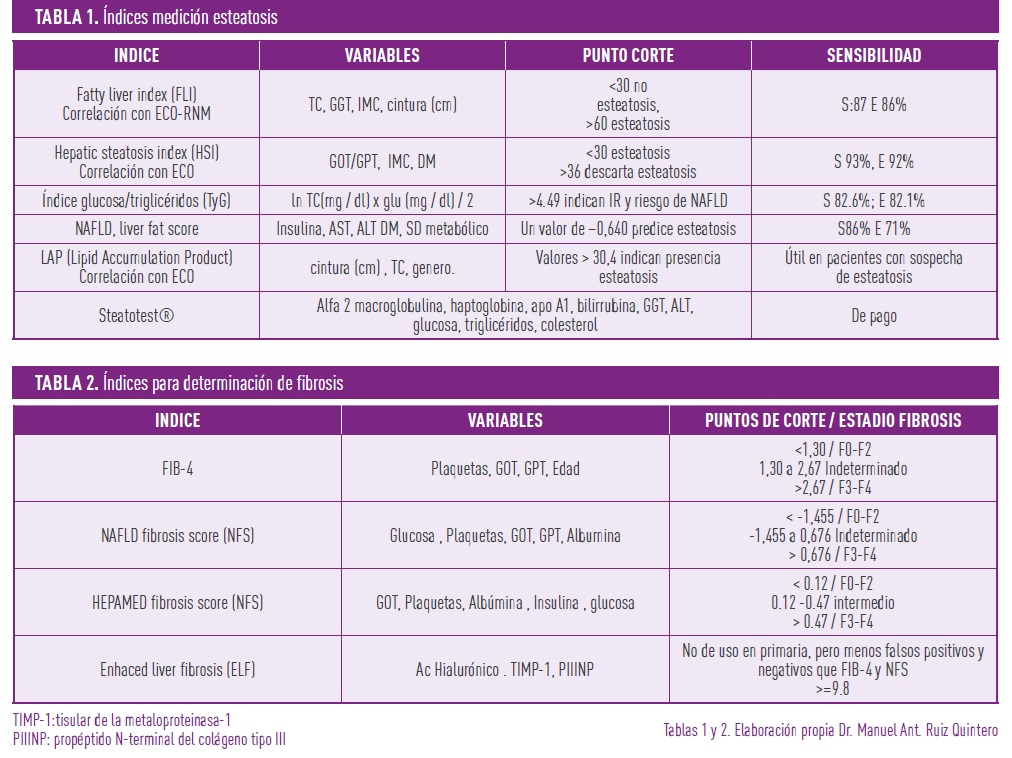
EL DIAGNÓSTICO DE LA NAFLD IMPLICA LA EXCLUSIÓN DE OTRAS CAUSAS DE ENFERMEDAD HEPÁTICA, COMO EL CONSUMO EXCESIVO DE ALCOHOL, LA HEPATITIS VIRAL Y LAS ENFERMEDADES AUTOINMUNES. ESTO SE REALIZA MEDIANTE LA EVALUACIÓN DE LA HISTORIA CLÍNICA DEL PACIENTE Y PRUEBAS DE LABORATORIO, COMO SON LA VALORACIÓN DE LA FUNCIÓN HEPÁTICA Y PRUEBAS SEROLÓGICAS QUE EXCLUYAN HEPATITIS VIRAL
Desde un punto de vista práctico, el NAFLD fibrosis score (NFS) y sobre todo el FIB-4 deben ser los métodos de cribado de la fibrosis, la asociación de los datos aportados por el FIB-4 y otro método no invasivo como la elastografía, puede evitar hasta un 75% de las biopsias con una correcta predicción hasta en el 90% de los casos (figura 2). FIB-4 es un índice diagnóstico que se basa en una fórmula matemática, utiliza los valores de la edad del paciente, la concentración de aspartato-aminotransferasa (GOT/AST), alanina-aminotransferasa (GPT/ALT) y plaquetas en sangre.
FIB-4 = (edad x GOT) / (plaquetas x √GPT)
Un resultado de FIB-4 < 1.3 indica bajo riesgo de fibrosis, valores más altos indican una mayor probabilidad de fibrosis. Es importante tener en cuenta que FIB-4 es solo un valor de detección y no puede proporcionar un diagnóstico definitivo de fibrosis hepática. Si se sospecha fibrosis, en un paciente con NAFLD, se deben realizar pruebas de imagen adicionales, como el Fibroscan o la MRE o una biopsia hepática, para confirmar el grado de fibrosis.
En la figura 2, se muestra una valoración en base a la combinación de métodos.
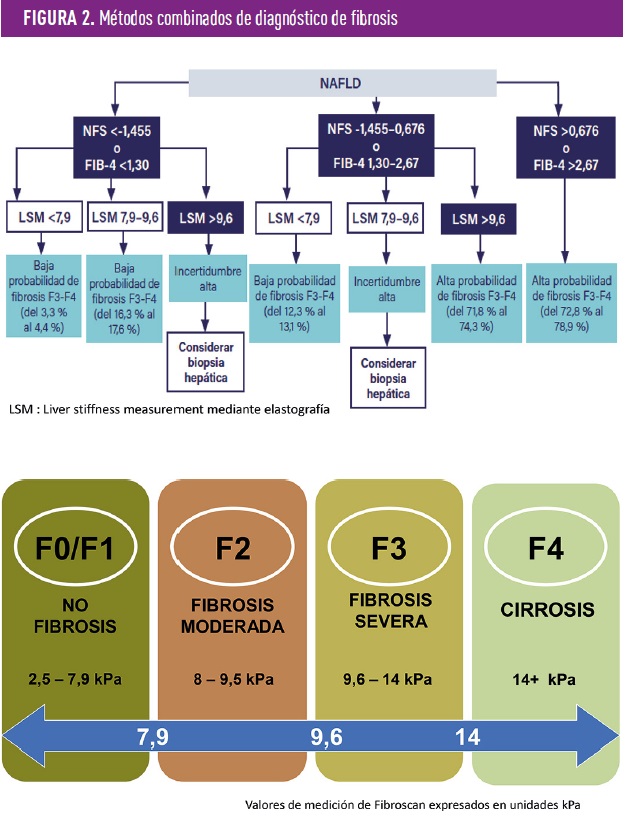
Actualmente se intenta simplificar el diagnóstico incluso con métodos en un sólo paso como es el Metabolomics-Advanced steatohepatitis fibrosis score (MASELF)8. Finalmente, la biopsia hepática (método gold standard) debe ser reservada para indicaciones puntuales debido a que es un método invasivo y conlleva ciertos riesgos, pero permite evitar errores diagnósticos y clasificar correctamente la enfermedad.
Tratamiento de la MAFLD
La reducción ponderal sigue siendo el objetivo terapéutico de mayor impacto. Una pérdida del 7% del peso corporal, mantenida en el tiempo, mejora los hallazgos histopatológicos, y una pérdida del 10% mejora el riesgo de fibrosis9. Así pues, una pérdida ponderal del 10% mantenida en el tiempo se asocia a reducciones en la mortalidad asociada a MAFLD, siendo útil además en el tratamiento de NAFLD (en ausencia de DM2). Una pérdida de peso modesta (5%) puede producir importantes beneficios, estos se magnifican con la práctica de ejercicio físico, tanto aeróbico como contra resistencia, pero han de ser mantenidos a lo largo del tiempo.
No hay que olvidar que estos pacientes van a tener un riesgo cardiovascular alto/muy alto y el abordaje terapéutico debe ser multifactorial, de todos los factores que contribuyen a este riesgo aumentado (tabaco, hipertensión, dislipemia, hiperuricemia …).

Seguir una dieta mediterránea puede reducir la grasa del hígado incluso sin perder peso y es el patrón dietético recomendado para MAFLD.
Hay que modificar el «fenotipo conductual de triple golpe” (sedentarismo, baja actividad física y mala alimentación). Es fundamental la realización de al menos 150 minutos de ejercicio a la semana, ejercicio prescrito y adaptado a los condicionantes clínicos y físicos de cada persona.
En la actualidad no hay ningún tratamiento farmacológico específico aprobado para el tratamiento de la NAFLD. Sin embargo, en presencia de DM2, disponemos de un importante arsenal terapéutico con múltiples evidencias10.
La Pioglitazona se recomienda en personas con DM2 y NASH o alta probabilidad de la misma (en base a niveles plasmáticos elevado niveles de aminotransferasa y pruebas no invasivas). Para ofrecer un beneficio cardiometabólico en personas con DM2 y NAFLD, se podría considerar el tratamiento con agonistas del receptor de GLP-1 (arGLP-1) o agonistas duales de los receptores GIP/GLP1, pioglitazona, inhibidores del co-trasportador sodio glucosa (iSGLT-2). Sin embargo, no hay evidencia de beneficio para el tratamiento de la NASH con iSGLT-2. A pesar de la falta de evidencia de eficacia, para la NASH, de la metformina, la acarbosa, los inhibidores de la dipeptidil peptidasa IV y la insulina, su uso debe ser continuado, según necesidad, para el tratamiento de la hiperglucemia en personas con DM2 y MAFLD o NASH. Actualmente no se pueden recomendar otras farmacoterapias para personas con NAFLD debido a la falta de pruebas sólidas de beneficio clínico.
En personas con DM2 los tratamientos con vitamina E no han sido eficaces.
La cirugía bariátrica y metabólica ha demostrado beneficios, tanto en esteatosis como en fibrosis en estudios a 5 años y es una opción terapéutica a considerar.
Conclusiones:
- Debemos ante la presencia de obesidad, DM2 o síndrome metabólico investigar la presencia de NAFLD. No está establecido claramente el cribado poblacional universal de la NAFLD.
- La NAFLD tiene una altísima prevalencia, pero un gran desconocimiento tanto por médicos como por pacientes.
- La NAFLD engloba un amplio espectro de lesiones, que van desde la esteatosis simple a la esteatohepatitis, con un grado variable de inflamación y la fibrosis, puede llegar a desarrollarse una cirrosis hepática compensada e incluso descompensada, y carcinoma hepático.
- Por otro lado, la MAFLD obliga a la búsqueda de la presencia de fibrosis. Para el diagnóstico de fibrosis se pueden utilizar los índices NFS y FIB-4, que utilizan una serie de variables tanto clínicas como analíticas fáciles de obtener en la práctica clínica habitual. En atención primaria se recomienda como técnica de imagen la ecografía. Ahora bien, los métodos radiológicos permiten el diagnóstico de la enfermedad, pero no determinan el grado de fibrosis.
- La presencia de MAFLD nos identifica al paciente como de alto riesgo.
- Hay que poner énfasis en los cambios de estilo de vida, la pérdida de peso revierte la esteatosis e incluso la fibrosis.
- En pacientes con MAFLD pueden tener utilidad el uso de terapias con evidencia para mejorar la esteatosis como los arGLP-1, ar duales GIP/GLP1, pioglitazona o iSGLT-2. Por último, la cirugía bariátrica ha demostrado mejorías en la esteatosis y en la fibrosis en estudios a largo plazo.
Bibliografía:
- Zhang X, Wu M, Liu Z, Yuan H, Wu X, Shi T, et al. Increasing prevalence of NAFLD/NASH among children, adolescents and young adults from 1990 to 2017: a population-based observational study. BMJ Open. 2021;11:e042843.
- Eslam M, Newsome PN, Sarin SK, Anstee QM, Targher G, Romero-Gomez M, et al. A new definition for metabolic dysfunction-associated fatty liver disease: An international expert consensus statement. J Hepatol (2020) 73(1):202–9. doi: 10.1016/j.jhep.2020.03.039.
- Powell EE, Wong VW-S,Rinella M. Non-alcoholic fatty liver disease. Lancet. 2021;397:2212-2224.
- Alina M. Allen, Jeffrey V. Lazarus, Zobair M. Younossi, Healthcare and socioeconomic costs of NAFLD: A global framework to navigate the uncertainties, Journal of Hepatology, 2023, feb 3:ISSN 0168-8278, https://doi.org/10.1016/j.jhep.2023.01.026.
- Riazi K, Azhari H, Charette JH, Underwood FE, King JA, Afshar EE, et al. The prevalence and incidence of NAFLD worldwide: a systematic review and meta-analysis. Lancet Gastroenterol Hepatol 2022;7:851–861.
- Stefan N, Cusi K. A global view of the interplay between non-alcoholic fatty liver disease and diabetes. Lancet Diabetes Endocrinol. 2022 Apr;10(4):284-296. doi: 10.1016/S2213-8587(22)00003-1. Epub 2022 Feb 17. PMID: 35183303
- Goh GB, McCullough AJ. Natural History of Nonalcoholic Fatty Liver Disease. Dig Dis Sci. 2016 May;61(5):1226-33. doi: 10.1007/s10620-016-4095-4. Epub 2016 Mar 22. PMID: 27003142; PMCID: PMC7789914.
- Noureddin M, Truong E, Mayo R, Martínez-Arranz I, Mincholé I, Banales JM, Arrese M, Cusi K, Arias-Loste MT, Bruha R, Romero-Gómez M, Iruzubieta P, Aller R, Ampuero J, Calleja JL, Ibañez-Samaniego L, Aspichueta P, Marín-Duce A, Kushner T, Ortiz P, Harrison SA, Anstee QM, Crespo J, Mato JM, Sanyal AJ. Serum identification of At-Risk MASH: The Metabolomics-Advanced steatohepatitis fibrosis score (MASEF). Hepatology. 2023 Jul 24. doi: 10.1097/HEP.0000000000000542. Epub ahead of print. PMID: 37505221.
- Romero-Gómez M, Zelber-Sagi S, Trenell M. Treatment of NAFLD with diet, physical activity and exercise. J Hepatol. 2017 Oct;67(4):829-846. doi: 10.1016/j.jhep.2017.05.016. Epub 2017 May 23. PMID: 28545937.
- Cusi K, Isaacs S, Barb D, Basu R, Caprio S, Garvey WT, Kashyap S, Mechanick JI, Mouzaki M, Nadolsky K, Rinella ME, Vos MB, Younossi Z. American Association of Clinical Endocrinology Clinical Practice Guideline for the Diagnosis and Management of Nonalcoholic Fatty Liver Disease in Primary Care and Endocrinology Clinical Settings: Co-Sponsored by the American Association for the Study of Liver Diseases (AASLD). Endocr Pract. 2022 May;28(5):528-562. doi: 10.1016/j.eprac.2022.03.010. PMID: 35569886







