La diabetes mellitus (DM) es un trastorno endocrino-metabólico crónico, caracterizado por la presencia de niveles elevados de glucosa en plasma (hiperglucemia), debidos a la falta de insulina (DM1) o a la resistencia periférica a su efecto (DM2), y con implicaciones multi-sistémicas, derivadas del daño oxidativo e inflamatorio ocasionado en los diferentes órganos y sistemas.
Un diagnóstico temprano de la diabetes y un control estricto de la hiperglucemia pueden prevenir o retrasar la aparición de complicaciones, que, en el tubo digestivo, incluyen reflujo gastroesofágico, estreñimiento crónico, despeños diarreicos, flatulencia y alteraciones del vaciado gástrico o gastroparesia1.
La gastroparesia o estasis gástrico es el término médico que define al vaciamiento gástrico lento (digestión pesada), en ausencia de obstrucción mecánica. Es el trastorno de la motilidad gástrica más común (de hecho, puede presentarse también en otras enfermedades o asociado a tratamientos médicos), más frecuente en las mujeres (aunque no se sabe por qué) y en pacientes obesos (muchos pacientes con DM2 lo son). El riesgo de desarrollar gastroparesia a 10 años es del 5% en DM1 y del 1% en DM2 (frente al 0.2% en personas sin diabetes). Afecta a un 25% de pacientes con diabetes y esta prevalencia va en aumento (en paralelo con la de DM), pero se piensa que la gastroparesia diabética está infradiagnosticada, porque los estudios de motilidad gástrica necesarios para el diagnóstico definitivo no se realizan rutinariamente y el diagnóstico se suele basar más en los síntomas (que, para complicar más la situación, pueden solapar con los de otras enfermedades)2.
La gastroparesia tiene un importante impacto en la calidad de vida de los pacientes (un 50-60% de pacientes la consideran mediocre o mala3). De hecho, aunque no está claro que aumente la mortalidad, sí aumenta claramente la morbilidad, con mayor necesidad de hospitalizaciones y visitas a los servicios de urgencias.
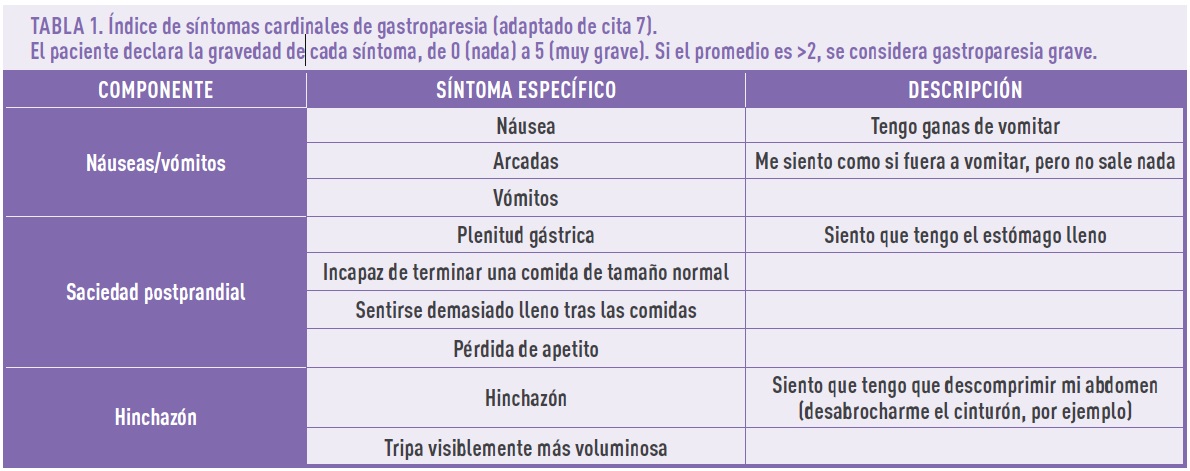
Los síntomas de gastroparesia incluyen sensación temprana de saciedad tras la ingesta (incluso cuando el volumen de comida ingerido es pequeño), hinchazón y dolor abdominal, náuseas, vómitos y dolor epigástrico (por la afectación del esófago a causa de reflujo, regurgitación y/o vómitos)1.
Las complicaciones asociadas a la gastroparesia son variadas, pero hay que tener en cuenta, especialmente, la malnutrición y la deshidratación, que pueden ocasionar déficits en micronutrientes como el hierro y las vitaminas D y B12 (en parte atribuibles a un mayor uso de antiácidos tipo omeprazol por estos pacientes4) y alteraciones en el equilibrio hidroelectrolítico. Otras complicaciones, más raras, pero muy problemáticas, son la neumonía por aspiración de contenido gástrico, o el bezoar gástrico (acumulación compacta de material parcialmente digerido o no digerido que no puede salir del estómago).
Como en otros órganos y sistemas, la hiperglucemia crónica puede inducir daño oxidativo e inflamatorio en los distintos elementos que controlan la motilidad gástrica1,2,5,6: las neuronas mientéricas, que residen en la pared muscular y controlan intrínsecamente su contractilidad (la diabetes produce neuropatía entérica, con un desequilibrio entre las neuronas excitadoras y las inhibidoras, y con alteración de las células gliales que las acompañan y protegen); las células intersticiales de Cajal, que funcionan como marcapasos de la pared gástrica (se pierde una gran proporción de estas células); y las propias capas musculares del estómago (con atrofia muscular y fibrosis). Además, los vasos que irrigan el estómago y los nervios que lo inervan (especialmente el nervio vago) también pueden verse afectados. Este conjunto de alteraciones se manifiesta, fundamentalmente, como falta de acomodación del fondo gástrico a la ingesta (el estómago proximal o fondo no se distiende adecuadamente y la presión dentro del estómago aumenta excesivamente), hipomotilidad del antro gástrico (el antro, que es la parte del estómago más cercana al píloro, deja de producir las contracciones potentes y coordinadas que, en ausencia de gastroparesia, propulsan el contenido gástrico al duodeno) y disfunción pilórica (el píloro, que es un esfínter, pierde la capacidad para relajarse adecuadamente y permitir el paso del alimento al duodeno)1.
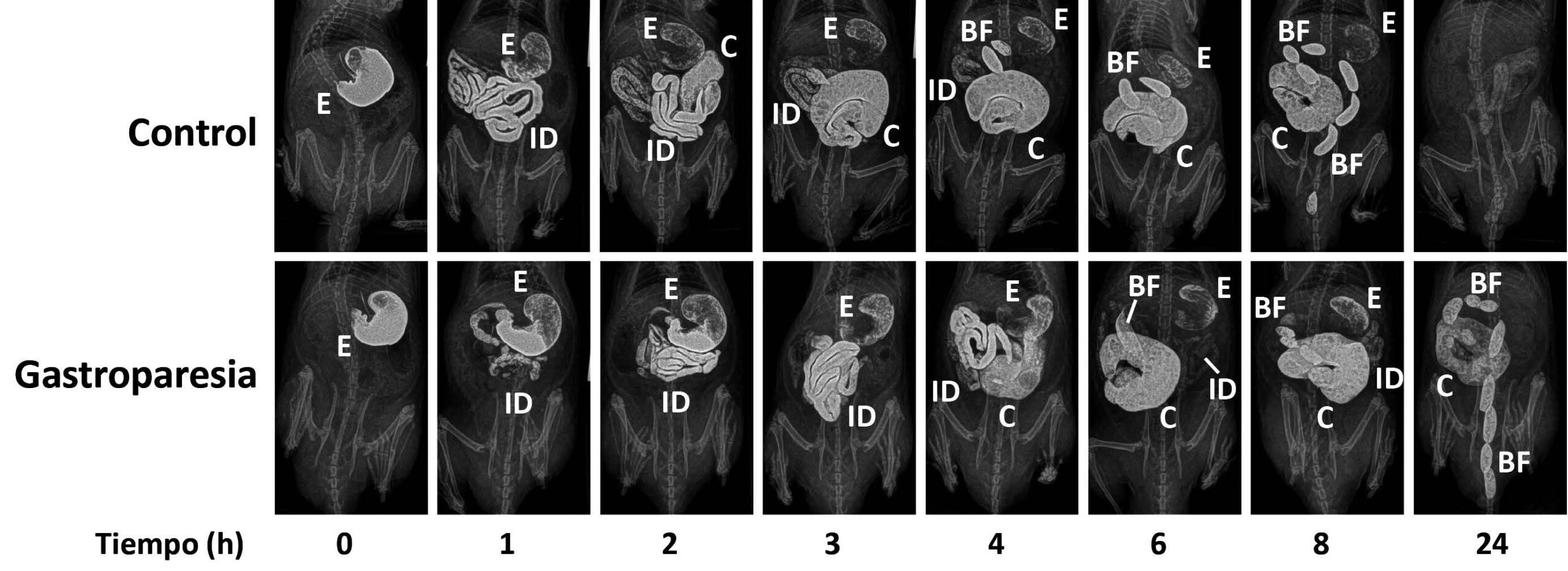
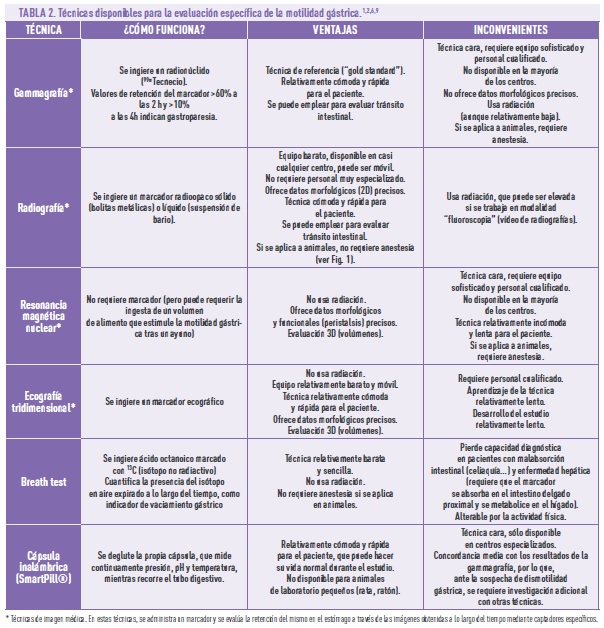
Teniendo en cuenta todo lo anterior, de cara al diagnóstico, además de evaluar adecuadamente los síntomas (Tabla 1)7, se deben descartar causas mecánicas (que el píloro no esté obstruido por un tumor o elemento extraño), mediante una endoscopia del tracto gastrointestinal superior. El siguiente paso en el diagnóstico es la evaluación específica del vaciamiento gástrico, mediante diversas técnicas, cada una con sus ventajas e inconvenientes (Tabla 2)2,6,8. Estas técnicas se emplean, igualmente, para determinar la eficacia de los tratamientos (también en los estudios preclínicos con animales: (ver Fig. 1).
El manejo de la gastroparesia diabética incluye estrategias dietéticas, médicas e invasivas (endoscópicas y quirúrgicas)1,2,6,9. Con respecto a las primeras, es esencial realizar una correcta evaluación nutricional y corregir, con la ayuda de los nutricionistas, los déficits nutricionales que se hayan podido identificar en las analíticas. Además, la ingesta de alimentos bajos en grasa, fibra y líquidos carbonatados, en tomas más pequeñas y frecuentes, favorecen el vaciamiento gástrico. En los casos graves, puede ser necesario ingerir los alimentos triturados, en forma de sopas, batidos y purés, dado que el vaciamiento de líquidos suele estar más preservado que el de sólidos en estos pacientes. En los casos muy graves, puede ser necesario realizar una yeyunostomía, un tipo de nutrición enteral que permite administrar los nutrientes directamente en el intestino, “saltándose” el estómago, pero que, como toda técnica quirúrgica, no está exenta de complicaciones. Como último recurso, quedaría la nutrición parenteral (colocar una vía intravenosa para la administración de nutrientes directamente en circulación sistémica), pero se ha de evitar siempre que sea posible, porque, entre otras complicaciones, puede facilitar el paso a circulación sistémica, a través de una mucosa atrofiada (por la “falta de uso”), de toxinas y microbios, con el consiguiente desarrollo de toxiinfecciones en estos pacientes.
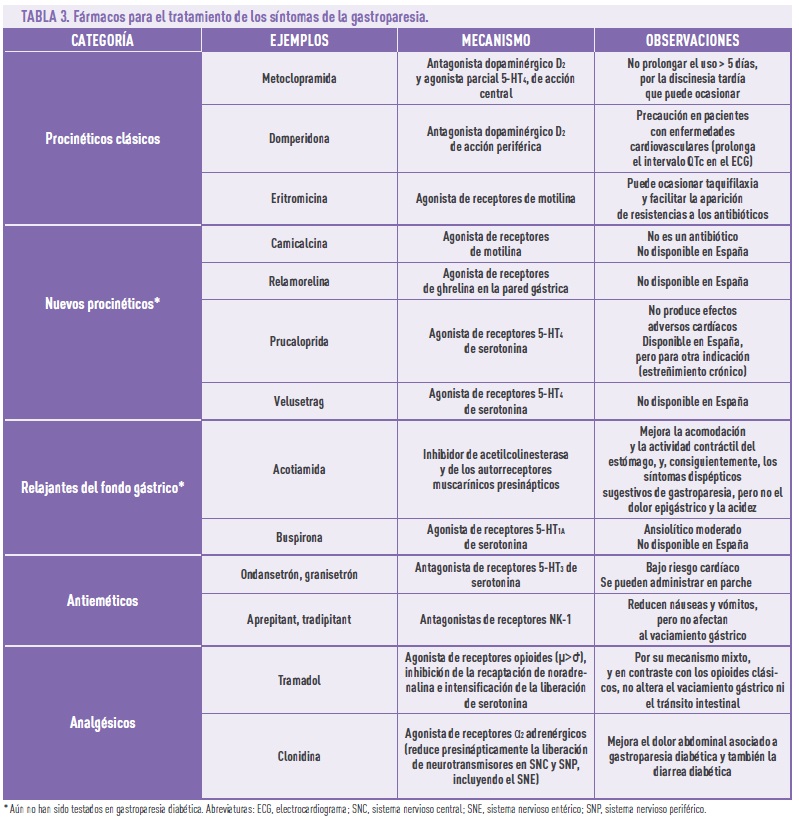
En cuanto a las medidas médicas, es importante mejorar el control glicémico, ya de por sí complicado, dado que la gastroparesia diabética retrasa la absorción de los nutrientes en cada ingesta y también altera la absorción oral de los fármacos. La implantación de bombas de insulina puede ser una buena ayuda en este sentido, aunque no es una solución barata. Además, es importante evitar el uso de fármacos que retrasan el vaciamiento gástrico, como algunos que se usan precisamente en el tratamiento de la DM2 (en concreto, los antidiabéticos inyectables, análogos del péptido 1 similar al glucagón: exenatida, liraglutida) o los analgésicos narcóticos (opioides). Estas medidas son muchas veces insuficientes y puede ser necesario administrar fármacos específicos para mejorar los síntomas (Tabla 3): procinéticos (que ocasionan contracciones del músculo gástrico, aceleran el vaciamiento gástrico y presentan efecto antiemético), relajantes del fondo gástrico (relajan el fondo o estómago proximal y reducen la presión intragástrica tras la ingesta de comida), antieméticos, analgésicos.
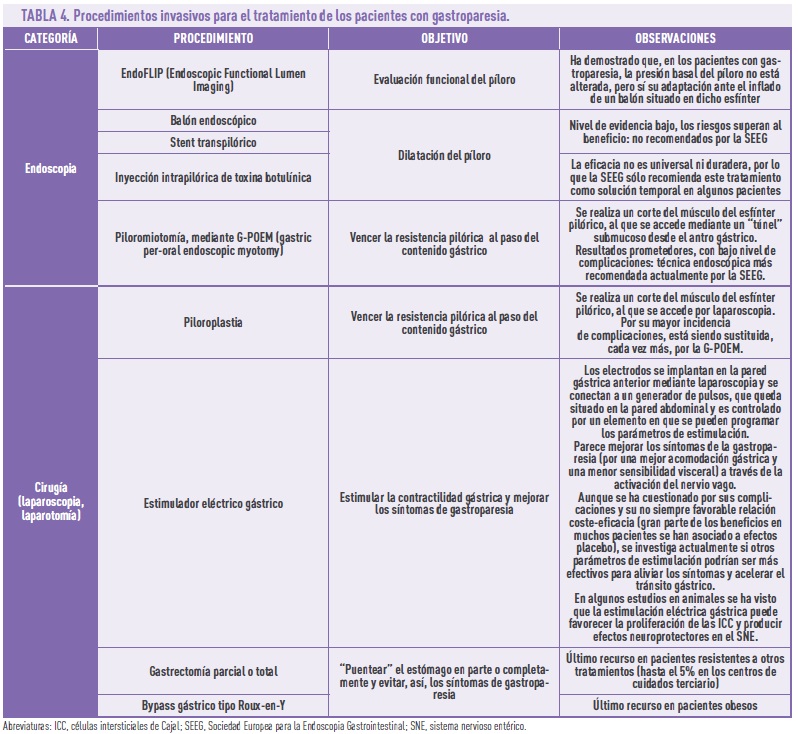
El tratamiento endoscópico puede ser necesario en el 25% de los pacientes que no se controlan adecuadamente con las medidas anteriores. El objetivo es reducir el impacto del piloroespasmo, que impide el paso del contenido (sobre todo sólido) del estómago al duodeno. Para ello, se han desarrollado varias estrategias, que incluyen también alguna quirúrgica (Tabla 4). El resto de las estrategias quirúrgicas (Tabla 4) están dirigidas a mejorar la contractilidad gástrica mediante estimulación eléctrica o bien, como último recurso, a “puentear” el estómago o parte de él para permitir la progresión del alimento a lo largo del resto del tracto gastrointestinal y facilitar así que continúe el proceso digestivo. Obviamente, las técnicas quirúrgicas se reservan para pacientes con síntomas muy graves y refractarios a las medidas anteriores.
Finalmente, se están ensayando otras estrategias para aliviar los síntomas, o, incluso, para tratar la gastroparesia diabética en sí, teniendo en cuenta los mecanismos moleculares y celulares que la ocasionan2,5,6,10.
- En cuanto al alivio de los síntomas, se propone la estimulación del nervio vago, que incrementa el tono parasimpático, mejora la función marcapasos de las ICC, modula la liberación de péptidos desde el tubo digestivo y reduce los niveles de marcadores inflamatorios en la circulación sistémica6.
- En cuanto a las estrategias dirigidas a los mecanismos etipatogénicos de la gastroparesia diabética, se ha propuesto el uso de agentes antioxidantes, antiinflamatorios y neuroprotectores que han demostrado eficacia en otras neuropatías (polineuropatías somáticas), pero aún no hay evidencias, o sólo en modelos animales, de su eficacia en la gastroparesia diabética5,6.
- Por otra parte, la pérdida de ICC parece asociarse a un proceso autoinmune en que se pierde un tipo concreto de células inmunes, los macrófagos CD206+, productores de hemo-oxigenasa 1, que protege frente a los radicales libres, por lo que ésta podría ser una diana interesante a explorar.
- Alternativamente, se han propuesto tratamientos farmacológicos que favorezcan la proliferación de las ICC y contribuyan a normalizar la motilidad gástrica. Además, para contrarrestar el déficit de óxido nítrico (NO), que relaja el músculo liso gastrointestinal y, por tanto, es esencial en la acomodación (relajación) del fondo gástrico, la relajación del píloro y la peristalsis del intestino delgado (mecanismo clave para la coordinación del tránsito gastrointestinal), se ha propuesto el uso de sepiapterina, un precursor bioquímico de la tetrahidrobiopterina (BH4), cofactor de la enzima NO sintasa de las neuronas mientéricas (inhibidoras) que liberan este neurotransmisor gaseoso.
En conclusión, la gastroparesia diabética es una entidad médica compleja con gran impacto en la calidad de vida de los pacientes que la sufren, que requiere la participación de múltiples especialistas para su manejo, el cual, actualmente, es puramente sintomático. Sin embargo, las nuevas estrategias terapéuticas que se están desarrollando para corregir las alteraciones moleculares y celulares asociadas a esta condición traen la esperanza de un panorama más prometedor para los pacientes afectados.
REFERENCIAS
- Concepción Zavaleta MJ, Gonzáles Yovera JG, Moreno Marreros DM, Rafael Robles LDP, Palomino Taype KR, Soto Gálvez KN, Arriola Torres LF, Coronado Arroyo JC, Concepción Urteaga LA. Diabetic gastroenteropathy: An underdiagnosed complication. World J Diabetes. 2021 Jun 15;12(6):794-809. doi: 10.4239/wjd.v12.i6.794.
- Camilleri M, Chedid V, Ford AC, Haruma K, Horowitz M, Jones KL, et al.. Gastroparesis. Nat Rev Dis Primers. 2018 Nov 1;4(1):41. doi: 10.1038/s41572-018-0038-z.
- Yu D, Ramsey FV, Norton WF, Norton N, Schneck S, Gaetano T, Parkman HP. The Burdens, Concerns, and Quality of Life of Patients with Gastroparesis. Dig Dis Sci. 2017 Apr;62(4):879-893. doi: 10.1007/s10620-017-4456-7.
- Amjad W, Qureshi W, Singh RR, Richter S. Nutritional deficiencies and predictors of mortality in diabetic and nondiabetic gastroparesis. Ann Gastroenterol. 2021 Nov-Dec;34(6):788-795. doi: 10.20524/aog.2021.0660.
- Uranga-Ocio JA, Bastús-Díez S, Delkáder-Palacios D, García-Cristóbal N, Leal-García MÁ, Abalo-Delgado R. Enteric neuropathy associated to diabetes mellitus. Rev Esp Enferm Dig. 2015 Jun;107(6):366-73.
- Meling S, Bertoli D, Sangnes DA, Brock C, Drewes A, Ejskjaer N, et al. Diabetic Gastroenteropathy, Soothe the Symptoms or Unravel a Cure? Curr Diabetes Rev. 2021 Mar 22. doi: 10.2174/1573399817666210322154618.
- Revicki DA, Rentz AM, Dubois D, Kahrilas P, Stanghellini V, Talley NJ, Tack J. Gastroparesis Cardinal Symptom Index (GCSI): development and validation of a patient reported assessment of severity of gastroparesis symptoms. Qual Life Res. 2004 May;13(4):833-44. doi: 10.1023/B:QURE.0000021689.86296.e4.
- Shi J, Shen H, Gao Q, Mulmi Shrestha S, Tan J, Lu T, Yang B. Evaluation of gastric emptying in patients with gastroparesis by three-dimensional ultrasound. Ann Transl Med. 2021 Aug;9(16):1343. doi: 10.21037/atm-21-3972.
- Rajamanuri M, Mannava SM, Chhabra J, Karwarker GV, Chahal M, Maligireddy AR, Dai E, Alfonso M. A Systematic Review of the Therapeutic Role of Gastric Pacemakers in Adults with Gastroparesis. Cureus. 2021 Sep 21;13(9):e18152. doi: 10.7759/cureus.18152.
- Jalleh RJ, Marathe CS, Jones KL, Horowitz M, Rayner CK. Digesting the pathogenesis of diabetic gastroparesis. J Diabetes Complications. 2021 Oct;35(10):107992. doi: 10.1016/j.jdiacomp.2021.107992.