La diabetes Mellitus tipo 1 (DM1) es una enfermedad en la que se ven implicados distintos factores que derivan en su patogenia. En primer lugar, se implican factores genéticos predisponentes vinculados al llamado HLA. En segundo lugar, sobre estos se añaden factores ambientales de muy diverso origen, se habla de dietéticos como la proteína de vaca en neonatos, infecciones víricas de diversos tipos, el más recientemente implicado el propio coronavirus SARS-Cov-2 … etc. En tercer lugar, consecuencia de ambos factores se activan mecanismos autoinmunes tanto celular como humoral que llevan a la inflamación y destrucción de la célula beta del Islote de Langerhans, marcadores de esta alteración autoinmune es la presencia en suero de autoanticuerpos frente la célula beta como son GAD, IA2, anti Zn-T8. Cuando la destrucción de la célula beta se traduce en una ausencia de insulina, sobreviene progresivamente la hiperglucemia, cetosis y acidosis salvo que se inicie antes el tratamiento con insulina.
Teniendo en cuenta los mecanismos implicados en el desarrollo de la DM1, podemos hablar de distintas estrategias para su tratamiento:
- Prevención de la destrucción inmune de la célula beta, diversos estudios han permitido identificar población de riesgo y mediante intervenciones dirigidas al sistema inmune, retrasando-evitando la aparición de DM1. Sin embargo, los estudios aún son incipientes y no aplicables en la clínica.
- Preservar la masa celular beta aún presente en el diagnóstico de la DM1, de manera que se prolongue al máximo una secreción de insulina residual que permita un mejor control de la enfermedad, con menos insulina y menos hipo-hiperglucemias.
- Remplazar o regenerar las células beta dañadas. En este campo están investigaciones como diferenciación de células progenitoras hacia células beta, generación en laboratorio de células beta, el propio trasplante de islotes de páncreas o el trasplante de páncreas como órgano completo.
- Sistemas automatizados de administración de insulina integrados con sensores, también llamados sistemas de asa cerrada o páncreas artificial.
En este artículo nos vamos a centrar en el trasplante de páncreas como órgano completo. Los primeros trabajos se publican en modelo animal, en concreto en 1892 cuando Hedon implantó una porción de páncreas en el tejido subcutáneo de un perro, previniendo el desarrollo de diabetes. En 1922, con el descubrimiento de la insulina por parte de Banting y Best, se frenó́ la investigación sobre el trasplante de páncreas, ya que el empleo de la insulina permitía aumentar la supervivencia de los pacientes con diabetes. Sin embargo, no tardaron en empezar a aparecer las complicaciones crónicas derivadas de la diabetes y los tratamientos para las mismas, entre ellos el trasplante renal como tratamiento de la nefropatía terminal. En la década de los 60 los avances en la inmunosupresión permitieron realizar el primer trasplante de páncreas en humanos. Fue en 1966 en la Universidad de Minnesota (EE. UU.) cuando Kelly y Lillehei implantaron de forma conjunta el páncreas y el riñón del cadáver de un donante a una mujer de 28 años afecta de diabetes tipo 1 e insuficiencia renal terminal. En nuestro país, el primer trasplante de páncreas se realiza en 1983 por el Prof. Fernández-Cruz en el Hospital Clínic de Barcelona.
En la actualidad, el trasplante de páncreas está indicado principalmente en pacientes con DM1, o DM2 insulinopénicos y no obesos, con tres posibles modalidades:
- Trasplante aislado de páncreas, indicado en pacientes con gran labilidad glucémica y frecuentes hipo-hiperglucemias de difícil control, o bien, pacientes con graves problemas con la administración exógena de insulina mediante pautas basal-prandial. Esta indicación ha perdido interés en los últimos años con el desarrollo de los modelos de asa cerrada bomba- sensor, siendo su indicación muy marginal.
- Trasplante de páncreas tras trasplante renal. En este caso, por lo general, se trata de un paciente en insuficiencia renal terminal con posibilidades de recibir un trasplante renal de un donante vivo compatible, de manera que con posterioridad se puede programar el trasplante de páncreas de un donante universal.
- Trasplante simultáneo de páncreas y riñón. Esta es la indicación más frecuente y en ella se incluyen pacientes con filtrado glomerular ≤ 20 mL/min, con previsible inicio de diálisis en menos de 1 año. Como veremos, en la actualidad no se debería ofertar el trasplante aislado de riñón a un paciente DM1 en insuficiencia renal terminal, salvo casos de contraindicación.
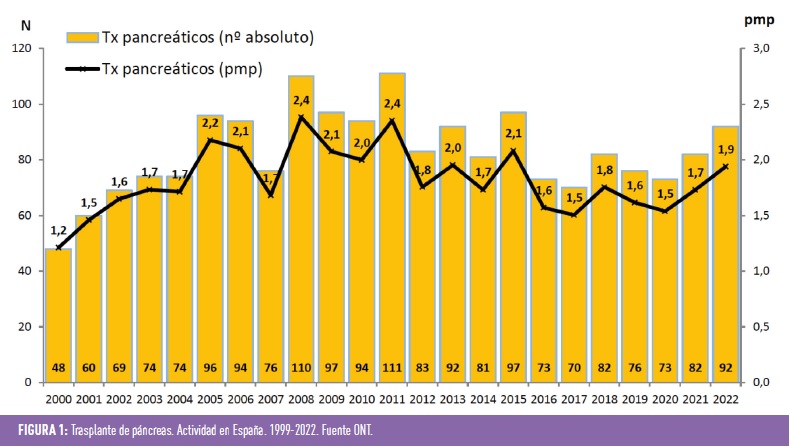
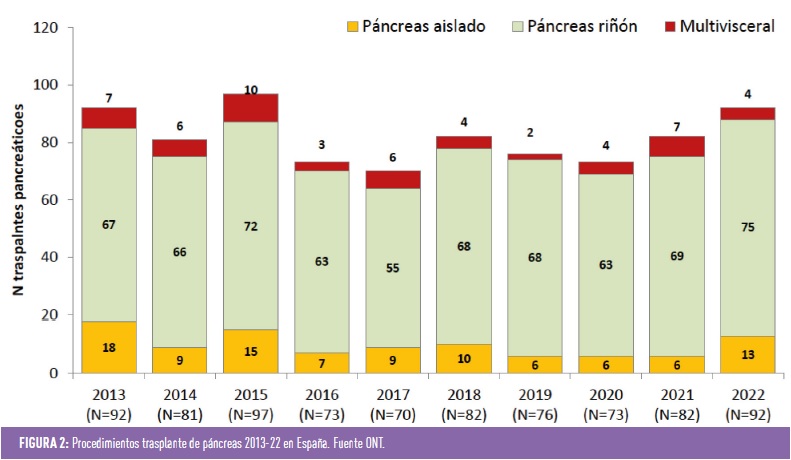
Si se revisan los datos de la Organización Nacional de Trasplante (ONT) (figura 1), se puede comprobar que en nuestro país en los últimos años el número de trasplantes de páncreas está entorno a los 2 por millón de habitantes, con aproximadamente 90 trasplantes/año (figura 2), siendo la modalidad más frecuente el doble trasplante páncreas-riñón. Estos datos son claramente inferiores a los esperables, teniendo en cuenta la prevalencia de DM1 y de insuficiencia renal terminal en pacientes afectos de DM1. Una explicación sería la no disponibilidad de unidades expertas en todas las áreas sanitarias, dato justificado por el bajo número de procedimientos al año, no obstante, sí que se debería potenciar el trabajo en red y la remisión de los posibles candidatos a centros de referencia con equipos multidisciplinares expertos.
Los resultados del trasplante de páncreas a corto y largo plazo justifican su indicación. Si lo analizamos por evolución de las complicaciones crónicas ligadas a la DM1 se puede resumir en:
- La retinopatía diabética presenta una estabilización significativa entre los 3-4 años.
- La nefropatía diabética en los casos de trasplante aislado de páncreas muestra una mejoría en el daño glomerular y disminución de la albuminuria entre los 4-10 años. Por su parte, si analizamos la supervivencia del injerto renal, esta es claramente superior en los trasplantes simultáneos de páncreas y riñón que en aquellos de solo trasplante renal. Esto justifica, que cuando esté indicado el trasplante renal en DM1, siempre se debe valorar el doble trasplante páncreas-riñón como una mejor opción.
- La neuropatía diabética presenta una mejoría tanto en su vertiente sensitiva como vegetativa entre los 4-10 años, con un mayor beneficio en los síntomas propios de la neuropatía vegetativa: gastroparesia, hipotensión ortostática, etc.
- Enfermedad y riesgo cardiovascular, es donde mayor beneficio se objetiva de manera precoz. Los pacientes que reciben un doble trasplante páncreas-riñón, rápidamente ven mejorado su riesgo cardiovascular a expensas de la normoglucemia, el mejor control de la tensión arterial y el mejor control lipídico, con un menor número de fármacos para controlar tensión arterial y colesterol. Esto se traduce en una mayor supervivencia con menor número de infartos en aquellos pacientes con DM1 que reciben un trasplante páncreas-riñón frente a los pacientes DM1 que reciben únicamente el trasplante renal.
A esto se debe añadir la mejor calidad de vida si se tiene en cuenta que se trata de un paciente afecto de DM1 en régimen de insulina basal-prandial con insuficiencia renal terminal, con frecuencia en diálisis, que pasa a un control perfecto de su diabetes sin insulina y a no necesitar diálisis. Estos resultados justifican que, a pesar del claro avance en terapia insulínica y desarrollo de los llamados modelos de páncreas artificial, el trasplante de páncreas siga teniendo una indicación con claro beneficio en aquellos casos de insuficiencia renal terminal con indicación de trasplante renal.
Referencias
- Skyler, J.S. Hope vs hype: where are we in type 1 diabetes? Diabetologia 2018; 61: 509–516. doi: https://link.springer.com/article/10.1007/s00125-017-4530-x.
- Pajvani UB, Sussel L. An Ultradian Notch in Beta-Cell Development. N Engl J Med. 2020 Jul 2;383(1):80-82. doi: 10.1056/NEJMcibr2001628.
- Yang EY, Kronenfeld JP, Stabler CL. Engineering biomimetic materials for islet transplantation. Curr Diabetes Rev. 2015;11(3):163-9. doi: 10.2174/1573399811666150317130440.
- Dean PG, Kukla A, Stegall MD, Kudva YC. Pancreas transplantation. BMJ. 2017 Apr 3;357:j1321. doi: 10.1136/bmj.j1321.
- Lindahl JP, Jenssen T, Hartmann A. Long-term outcomes after organ transplantation in diabetic end-stage renal disease. Diabetes Res Clin Pract. 2014 Jul;105(1):14-21. doi: 10.1016/j.diabres.2014.03.004.
- Lindahl JP, Hartmann A, Aakhus S, Endresen K, Midtvedt K, Holdaas H, et al.. Long-term cardiovascular outcomes in type 1 diabetic patients after simultaneous pancreas and kidney transplantation compared with living donor kidney transplantation. Diabetologia. 2016 Apr;59(4):844-52. doi: 10.1007/s00125-015-3853-8.
- Argente-Pla M, Pérez-Lázaro A, Martínez-Millana A, Del Olmo-García MI, Espí-Reig J, Beneyto-Castello I et al. Simultaneous Pancreas Kidney Transplantation Improves Cardiovascular Autonomic Neuropathy with Improved Valsalva Ratio as the Most Precocious Test. J Diabetes Res. 2020 Apr 6;2020:7574628. doi: 10.1155/2020/7574628.
- https://www.ont.es/wp-content/uploads/2023/06/DONACION-Y-TRASPLANTE-PANCREATICO-2022.pdf. Consultado 1 de junio de 2023.







