¿Refleja la clasificación actual de la diabetes mellitus la base fisiopatológica?
La diabetes mellitus (DM) comprende un conjunto heterogéneo de entidades clínicas con el denominador común de niveles crónicamente elevados de glucosa en sangre.
Clásicamente la diabetes se subdivide en dos grandes grupos: diabetes tipo 1 (DM1) y la diabetes tipo 2 (DM2). Además, hay otros grupos bien caracterizados como la diabetes gestacional, la diabetes monogénica, la diabetes tipo 3c y la secundaria a fármacos.
Tal y como enfocamos el diagnóstico, tanto la DM1 como la diabetes monogénica, la DM3c, la diabetes gestacional o la diabetes secundaria a fármacos son diagnósticos excluyentes. Una vez descartadas estas entidades, todas las demás hiperglucemias las denominamos DM2. En definitiva, la DM2 se concibe como un cajón que incluye a todas las hiperglucemias crónicas no encuadrables en los tipos anteriores. Sin embargo, la mayoría de los casos de diabetes se atribuyen al tipo 2 (90-95%) y, por lo tanto, no es lógico considerar exista gran homogeneidad en el fenotipo DM2.
Las dificultades para la clasificación clásica aparecen cuando sujetos adultos etiquetados como DM2 muestran características inmunológicas similares a la diabetes tipo 1, sujetos con DM1 muestran insulinresistencia u obesidad típica de la DM2, algunos sujetos con DM2 pueden presentan cetoacidosis o niños con hiperglucemias más parecidas a las de sujetos adultos (MODY). Además, la progresión de la enfermedad es muy variable en las personas con diabetes, al igual que el desarrollo de complicaciones, independientemente del grado de control de la glucemia y a pesar del control glucémico comparable.
¿Cuál es la causa de la heterogeneidad de la diabetes mellitus?
Los avances de las herramientas para el análisis de biología molecular y genética en las últimas décadas han facilitado el descubrimiento de asociaciones que sugieren fisiopatologías diferenciadas dentro de los tipos clásicos de diabetes.
La diabetes tipo 1 y la diabetes tipo 2 no son entidades monolíticas. Ambas son entidades poligénicas que interaccionan con factores medioambientales y de estilo de vida. Todo ello modulado por el deterioro fisiológico producido por el avance de la edad. Sobre esta base, los sujetos desarrollan diferencias inmunológicas, metabólicas, del grado inflamación, de insulino resistencia y de adiposidad (cantidad, calidad y distribución) que repercuten en la homeostasis del metabolismo hidrocarbonado, en su evolución clínica y en el pronóstico para el desarrollo de complicaciones asociadas.
Esta heterogeneidad no es capturada por la clasificación actual; y las pautas para el diagnóstico y tratamiento de la diabetes siguen un criterio uniforme que no se ajusta a la compleja realidad fisiopatológica y clínica. En definitiva, se precisa otra forma de clasificación.
¿Sirve la clasificación actual de los tipos de DM2 para el manejo clínico de los sujetos?
Lo que hacemos en la actualidad es tomar decisiones terapéuticas en función de características clínicas (edad, peso, nivel de glucemia, riesgo cardiovascular, etc.). En función de ello, elegimos una estrategia farmacológica que complementa el plan de alimentación y de actividad física recomendado en las guías clínicas.
La estructura de macronutrientes y micronutrientes de la alimentación y el plan de actividad física siguen directrices uniformes. Ambas estrategias no contemplan las diferencias fisiopatológicas y clínicas subyacentes. Por su parte, las decisiones farmacológicas siguen estrategias mecanicistas, sustentadas por las evidencias de ensayos controlados y aleatorizados que incluyen grandes grupos de sujetos. Sin embargo, estos estudios no excluyen la existencia de grupos de individuos en los que la efectividad de estos fármacos es superior o menor a lo establecido en el conjunto global. Detectar a estos sujetos con respuestas fuera del rango, emerge como un objetivo de la medicina de precisión.
La estrategia actual para la toma de decisiones hace que el esfuerzo terapéutico y, por lo tanto, su repercusión en la calidad de vida y en el coste sea igual para todos los individuos diagnosticados con el fenotipo de DM2. Sin embargo, la realidad es que el potencial de desarrollo de complicaciones para un mismo valor de glucemia o la respuesta a la terapia instaurada es diferente para los sujetos de este fenotipo. Por lo tanto, el objetivo final, quizás utópico en el presente, es elegir la estrategia terapéutica más eficiente para cada individuo (figura1)
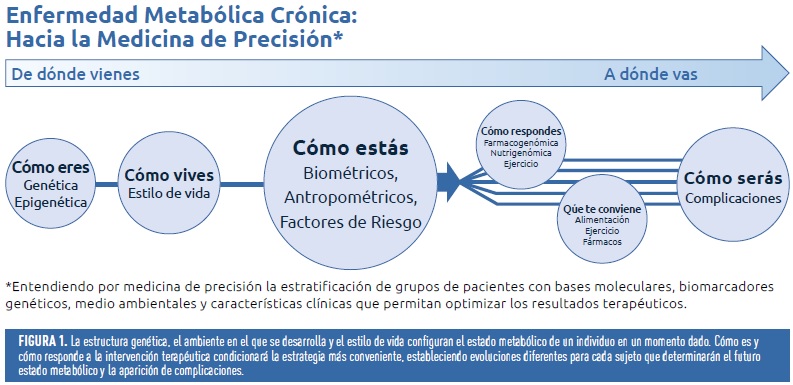
¿Por qué fenotipar en diabetes mellitus?
Las personas con un reciente diagnóstico de diabetes mellitus tienen deficiencias en uno o varios procesos fisiológicos dando lugar a combinaciones que cristalizan en cuadros clínicos con características, evolución y pronóstico diferentes.
Pueden coexistir alteraciones de la función de célula beta (resistencia a la respuesta de la glucosa o deterioro con disminución de la producción de insulina), alteraciones de la autoinmunidad pancreática, grados variables de inflamación, deterioro de la sensibilidad a la insulina en hígado y músculo, disminución de actividad incretina, deterioro de la cantidad y funcionalidad muscular y, también, anomalías de la función del tejido adiposo, tanto en cantidad, como en calidad y distribución. Este amplio espectro de factores, intervienen con diferentes intensidades y generan alteraciones fisiopatológicas con diferente clínica, respuesta variable a las estrategias terapéuticas y diferente pronóstico de complicaciones.
Una o varias vías fisiopatológicas entremezcladas configuran un fenotipo concreto; y presenta una clínica, evolución, pronóstico y respuesta a la terapia propia del grupo. Cada individuo, se coloca en algún lugar dentro del grupo en función del espectro de la variación de cada rasgo según lo determinado por su genética, modulada por las exposiciones medioambientales (epigenética), el estilo de vida y el avance de la edad.
La reciente capacidad de manejar grandes cantidades de datos poblacionales aumenta la evidencia de la heterogeneidad dentro de los tipos de diabetes y facilita la agrupación en fenotipos más homogéneos. Fenotipar en DM2 supone establecer grupos más homogéneos en los que la estratificación de pacientes permite un manejo y tratamiento más ajustado a su pronóstico de riesgo. Por lo tanto, recurrir a estrategias que homogeneicen grupos de sujetos dentro de la entidad DM2 se impone como el abordaje más razonable para una diabetes de precisión.
¿Cómo entendemos el concepto de diabetes de precisión?
En los últimos 10 años se ha generado un progreso sin precedentes en la comprensión de las bases genéticas, epigenética, moleculares y fisiopatológicas de la diabetes. Con este importante progreso, aumenta la expectativa sobre la capacidad para diagnosticar, caracterizar y tratar a los pacientes con mayor eficiencia. En este sentido, entendemos por medicina de precisión la estratificación en grupos de pacientes con bases moleculares, biomarcadores genéticos, estilo de vida y características clínicas que permitan optimizar los resultados terapéuticos. Es un paso intermedio hacia la medicina individualizada. Una forma más realista de asumir la medicina individualizada; difícil de abarcar en la actualidad por la gran multitud de variantes. En definitiva, se trata de contestar a las preguntas: ¿Cómo eres? (genética)¿En qué ambiente te has desarrollado?( epigenética) ¿cómo vives?( estilo de vida) ¿Cómo podrás estar? y ¿Cómo responderás a fármacos, dieta y ejercicio? (figura 1) Se trata de explorar el manejo clínico, pasando de la idea de grupo (DM2) al subgrupo o fenotipo y, finalmente, al individuo en un futuro posible.
Del genotipo al fenotipo y viceversa, pasando por el endotipo
¿Qué es mejor, clasificar subtipos de DM2 en función de un conjunto de genes (genotipo) o en función de parámetros clínicos (fenotipo)? La respuesta está por dilucidar en la actualidad.
En teoría, los grupos genéticos pueden identificar subconjuntos de individuos para quienes el riesgo del fenotipo DM2 está relacionado principalmente con una o más vías fisiopatológicas diferenciadas. En esa situación ideal, el riesgo genético de una persona se puede calcular utilizando una puntuación poligénica específica. Este enfoque es el realizado por Udler y cols. (2018). Estos autores, sobre una base de 94 variantes genéticas, agrupan a los sujetos en 6 fenotipos con una clínica, vías fisiopatológicas, alteraciones metabólicas y complicaciones perfectamente diferenciadas entre grupos.
Por el contrario, Ahlqvist y cols. (2018). clasifican a los sujetos con DM2 recién diagnosticados utilizando 6 variables clínicas predeterminadas. En función de ellas, agrupan a los sujetos en 5 fenotipos con características clínicas y complicaciones micro o macroangiopáticas específicas del grupo. Pero también asocian estos fenotipos a variantes genéticas y vías fisiopatológicas.
El concepto endotipo se refiere a los mecanismos fisiopatológicos subyacentes asociados a un fenotipo. El concepto de endotipo supone, entre otros aspectos, que una misma estrategia aplicada a toda una población solo será eficaz para el subgrupo que presente las vías fisiopatológicas más próximas a los mecanismos de acción de la estrategia escogida.
Un endotipo simple o binario es, por ejemplo, la diabetes monogénica: un gen, una vía fisiopatológica (endotipo), una clínica asociada y una estrategia terapéutica definida. Sin embargo, la mayoría de los endotipos en DM2 son complejos, entremezclando genes y vías fisiopatológicas para desarrollar la clínica de un fenotipo. No es fácil acotar un endotipo en DM2. Buscando entre los grupos de respondedores a un tratamiento se puede encontrar el endotipo subyacente a ese fenotipo de respondedor que sirva para estratificar a los sujetos pensando en el riesgo de complicaciones y permita en la adopción de estrategias clínicas más individualizadas.
En conclusión, el genotipo es necesario para el diagnóstico de las diabetes monogénicas, pero la estimación del riesgo genético no tiene suficiente potencial predictivo en la DM2. por el impacto del estilo de vida y variables medioambientales que complican la detección de endotipos. Por otro lado, hay limitaciones por barreras de accesibilidad y asequibilidad para los estudios genéticos en la práctica clínica diaria.
Por el contrario, la categorización en fenotipos en función de variables clínicas es accesible y asequible en la práctica médica diaria. Es una forma posibilista de asumir el enfoque de una diabetes de precisión en la actualidad.
LAS DIFICULTADES PARA LA CLASIFICACIÓN CLÁSICA APARECEN CUANDO SUJETOS ADULTOS ETIQUETADOS COMO DM2 MUESTRAN CARACTERÍSTICAS INMUNOLÓGICAS SIMILARES A LA DIABETES TIPO 1, SUJETOS CON DM1 MUESTRAN INSULINRESISTENCIA U OBESIDAD TÍPICA DE LA DM2, ALGUNOS SUJETOS CON DM2 PUEDEN PRESENTAN CETOACIDOSIS O NIÑOS CON HIPERGLUCEMIAS MÁS PARECIDAS A LAS DE SUJETOS ADULTOS (MODY)
Modelos de fenotipado en función de variables clínicas: ¿cómo fenotipar?
Con las herramientas de minería de datos y “machine learning”, por su capacidad para manejar grandes cantidades de datos y generar modelos predictivos, se consigue profundizar en la diversidad genética, fisiopatológica y clínica de la DM y con esa base desarrollar unos fenotipos en DM2 que nos permitan mejorar la precisión de las estrategias terapéuticas.
Utilizando registros médicos electrónicos y datos extensos de genes, se han buscado modelos basados en métodos de topología, de índices de riesgo genético, de análisis trayectoria de parámetros clínicos y técnicas de agrupamiento sobre variables clínicas.
La última metodología es la que más repercusión clínica ha tenido en base a los estudios de Ahlqvist y cols. Con el algoritmo” K-means”, agrupan a los sujetos con diagnóstico reciente de diabetes en función de seis variables clínicas preestablecidas: presencia de autoanticuerpos GAD65, edad en el momento del diagnóstico de diabetes, valor de HbA1c, índice de masa corporal y sensibilidad insulina (HOMA2-IR), función célula beta (HOMA2-B). Los resultados muestran la existencia de 5 fenotipos diferenciados. Uno de ellos con autoanticuerpos GAD65+, posiblemente fenotipo LADA mal etiquetado, pero los otros 4 son fenotipos claramente diferenciados dentro de la DM2, disminuyendo la heterogeneidad intragrupo con respecto a la simple etiqueta de DM2 (figura 2).
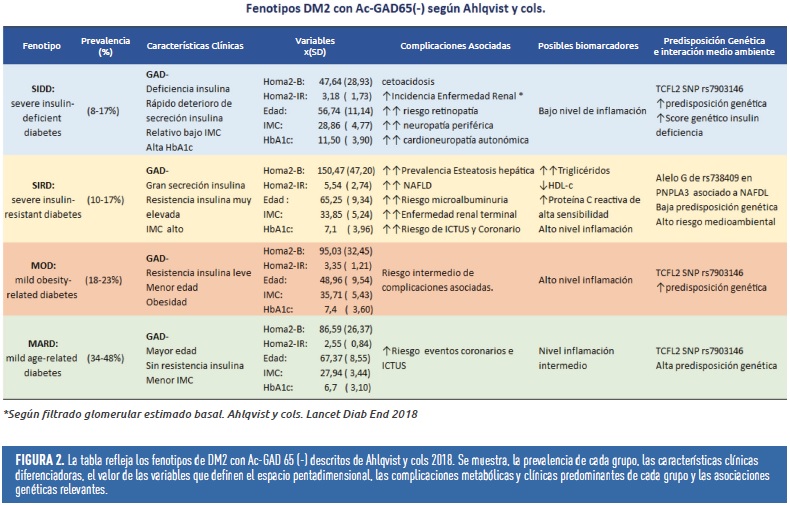
Estos subgrupos muestran patrones clínicos distintos, diferente progresión de inicio de comorbilidades y complicaciones, siendo el fenotipo con mayor resistencia a la insulina el de mayor riesgo de hígado graso y de enfermedad cardiorrenal, por ejemplo.
Es importante destacar que la pertenencia o no a un grupo no depende de un solo parámetro, sino de estar localizado dentro del espacio multidimensional perimetrado por las variables que definen el grupo. En el caso de Ahlqvist y cols. (2018), la variable Ac-GAD65 es binaria: positiva o negativa, pero las demás son de grado y no utilizan niveles de corte. Por lo tanto, definen un espacio de pentadimensional (hexátetron) en el que el sujeto está o no está, según el criterio de la sistemática utilizada (Figura 3).
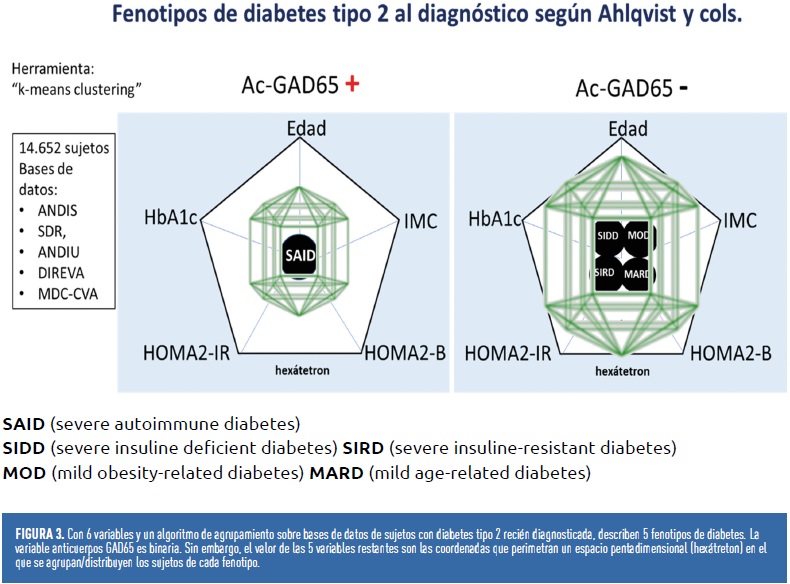
Hay varias cuestiones metodológicas y prácticas que necesitan más estudio en la confección de estos grupos, tanto por el método utilizado para definir subgrupos y su estabilidad a lo largo del tiempo como por la generalización de los hallazgos y la aplicabilidad en la atención clínica de rutina. No obstante, aunque aún hay lagunas y zonas muy abiertas a discusión, este nuevo enfoque en la consideración de la diabetes tipo 2 como un conjunto de fenotipos ofrece el atractivo de un abordaje terapéutico más ajustado en el camino hacia la medicina de precisión
UTILIZANDO REGISTROS MÉDICOS ELECTRÓNICOS Y DATOS EXTENSOS DE GENES, SE HAN BUSCADO MODELOS BASADOS EN MÉTODOS DE TOPOLOGÍA, DE ÍNDICES DE RIESGO GENÉTICO, DE ANÁLISIS TRAYECTORIA DE PARÁMETROS CLÍNICOS Y TÉCNICAS DE AGRUPAMIENTO SOBRE VARIABLES CLÍNICAS.
¿Qué utilidad tiene fenotipar en DM2 en la actualidad?
Aún es pronto para poder utilizar todo el potencial de la estrategia de fenotipado. Si bien se ha teorizado que los pacientes de estos subgrupos se beneficiarían de abordajes específicos, se necesitan estudios aleatorizados y controlados para evaluar la utilidad clínica de estrategias terapéuticas diferenciadas en función del grupo, tanto en alimentación como en actividad física o asociaciones farmacológicas.
Sin duda faltan datos, pero es posible apreciar su potencial en la medicina de precisión. Posiblemente, en el momento actual sólo hemos pasado de un cajón muy heterogéneo, denominado DM2, a 4 cajones con más homogeneidad, pero aún heterogéneos y, por lo tanto, con subgrupos dentro de ellos aún por definir.
No obstante, fenotipar a los sujetos con este modelo de Ahlqvist y cols. (2018). desde el mismo momento del diagnóstico de DM2 permite sospechar el tipo de complicaciones que presentarán posiblemente con mayor frecuencia, la velocidad de deterioro de la célula beta o la vía fisiopatológica predominante y, en función de ello, se elegir una estrategia terapéutica más temprana y eficiente desde el diagnóstico. En función del fenotipo, podemos considerar la utilidad de modificar la relación de macronutrientes de la alimentación, individualizar la proporción entre el volumen de ejercicio de fuerza y aeróbico prescrito o elegir el tipo de fármaco hipoglucemiante con beneficios más allá de la glucemia. Todo ello, desde el diagnóstico, aunque aún en el terreno de las hipótesis.
En conclusión, la heterogeneidad clínica difumina la categorización clásica de la diabetes mellitus y las técnicas de análisis de grandes conjuntos de datos sobre las diferentes ómicas, permiten agrupar a los sujetos en fenotipos clínicos más homogéneos. De esta forma, se perfilan estrategias de alimentación, de actividad física y farmacológicas más eficientes, minimizando el impacto en la calidad de vida del sujeto y el coste global. Por ello, es importante profundizar en el fenotipado como forma de avanzar en la medicina de precisión y, en la medida de lo posible, incorporarlo a la práctica clínica diaria.
Referencias recomendadas.
- Ahlqvist E, Prasad RB, Groop L Towards improved precision and a new classification of diabetes mellitus. J Endocrinol 2022. 252: R59–R70. https://doi.org/10.1530/JOE-20-0596
- Ahlqvist E, Storm P, Käräjämäki A et al. Novel subgroups of adult-onset diabetes and their association with outcomes: a data driven cluster analysis of six variables. Lancet Diabetes Endocrinol 2018 6(5):361–369. https://doi.org/10.1016/S2213-8587(18)30051-2
- Battaglia M, Ahmed S, Anderson MS et al .Introducing the endotype concept to address the challenge of disease heterogeneity in type 1 diabetes. Diabetes Care 2020;43(1):5–12. https://doi.org/10.2337/dc19-0880
- Deutsch Aj, Ahlqvist E & Miriam S. Udler. Phenotypic and genetic classification of diabetes. Diabetologia 2022. 65: 1758–1769. https://doi.org/10.1007/s00125-022-05769-4
- Herder, C., Roden, M. A novel diabetes typology: towards precision diabetology from pathogenesis to treatment. Diabetologia 2022. 65:1770–1781. https://doi.org/10.1007/s00125-021-05625-x
- Hulman A, Witte DR, Vistisen D et al .Pathophysiological characteristics underlying different glucose response curves: a latent class trajectory analysis from the prospective EGIR-RISC study. Diabetes Care 2018;41(8):1740–1748. https://doi.org/10.2337/dc18-0279
- Li L, ChengWY, Glicksberg BS et al . Identification of type 2 diabetes subgroups through topological analysis of patient similarity. Sci Transl Med 2015; 7(311):311ra174. https://doi.org/10.1126/scitranslmed.aaa9364
- Redondo MJ, Hagopian WA, Oram R et al. The Clinical consequences of heterogeneity within and between different diabetes types. Diabetologia 2020: 63(10):2040–2048 https://doi.org/10.1007/s00125-020-05211-7
- Slieker RC, Donnelly LA, Fitipaldi H et al. Replication and cross-validation of type 2 diabetes subtypes based on clinical variables: an IMI-RHAPSODY study. Diabetologia 2021.64(9):1982–1989. https://doi.org/10.1007/s00125-021-05490-8
- Udler MS, Kim J, von Grotthuss M et al. Type 2 diabetes genetic loci informed by multi-trait associations point to disease mechanisms and subtypes: a soft clustering analysis. PLoS Med 2018;15(9):e1002654. https://doi.org/10.1371/journal.pmed.1002654
- Udler MS, McCarthy MI, Florez JC, Mahajan A. Genetic Risk Scores for Diabetes Diagnosis and Precision Medicine. Endocr Rev. 2019 Dec 1;40(6):1500-1520. https://doi.org/10.1210/er.2019-00088.







