La diabetes mellitus tipo 1 (DM1) es una enfermedad de origen autoinmune, en la cual se produce una destrucción de las células beta pancreáticas, productoras de insulina, a través de mecanismos mediados por una respuesta inmune inadecuada de la propia persona que la padece. El conocimiento de estos mecanismos ha aumentado mucho en los últimos años. Actualmente se conoce que existe una predisposición genética para padecer la enfermedad, sobre la que actuarían ciertos agentes ambientales (infecciones, factores nutricionales, etc.) que iniciarían el proceso autoinmune. En fases iniciales de la enfermedad, la función pancreática es todavía normal, pero cuando la destrucción de las células beta progresa, la capacidad de regular la glucemia se pierde, y es cuando aparecen las manifestaciones clínicas de la diabetes. El tratamiento actual de la DM1 es esencialmente un tratamiento sustitutivo, aportando la insulina que el páncreas ya no es capaz de producir.
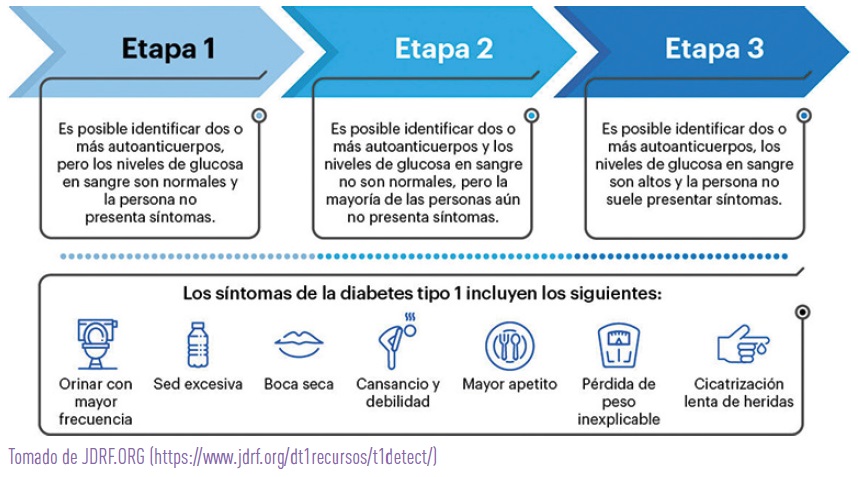
Para comprender mejor esa evolución del proceso autoinmune, se diferencian 3 etapas o estadios de desarrollo de la DM1:
- ESTADIO 1: positividad de dos o más auto-anticuerpos relacionados con la diabetes. Es la fase inicial de la DM1. El sistema inmunitario ya ha comenzado a atacar las células beta que producen la insulina, aunque los valores de glucosa en sangre son normales y no hay síntomas de diabetes.
- ESTADIO 2: además de presentar auto-anticuerpos positivos, la masa de células beta se va reduciendo debido a la destrucción por parte del sistema inmunológico, y por ello, los niveles de glucosa en sangre comienzan a elevarse (disglucemia), pero todavía no hay síntomas de diabetes.
- ESTADIO 3: ya hay una pérdida significativa de células beta, aparece la hiperglucemia y los síntomas típicos de la DM1, que incluyen micción frecuente, sed excesiva, pérdida de peso y fatiga. En la actualidad, este es el momento en el que habitualmente se diagnostica y empieza a tratar la diabetes.
EN NOVIEMBRE DE 2022, LA FDA (AGENCIA DE REGULACIÓN DE MEDICAMENTOS DE ESTADOS UNIDOS), APROBÓ POR PRIMERA VEZ EL USO DE TEPLIZUMAB PARA FRENAR LA PROGRESIÓN DE LA DIABETES
Los estudios a largo plazo muestran que prácticamente el 100% de las personas en estadio 1 y 2 desarrollarán DM1 a lo largo de su vida1. Por ello, en las últimas dos décadas se han intentado plantear y poner en marcha estrategias con el objetivo de poder diagnosticar la diabetes en estadios iniciales. Esto tendría dos objetivos principales. El primero, las personas en estadios presintomáticos podrían ser monitorizados periódicamente, y ellos y las familias de los niños diagnosticados en estos estadios, podrían ser formados para reconocer los primeros síntomas de la enfermedad, evitando la progresión hacia la cetoacidosis diabética, que es la forma de presentación más grave de la enfermedad en el momento del diagnóstico. El segundo objetivo sería poder ofrecer a las personas en estadios 1 y 2 un tratamiento que pueda modificar la historia natural de la diabetes, evitando, o al menos retrasando, la aparición de la diabetes clínica.
Desde hace años, investigadores en todo el mundo buscan desarrollar un tratamiento, o una combinación de tratamientos que fuesen capaces de frenar la destrucción de las células beta, tanto al diagnóstico de la enfermedad, como, si fuese posible, en las fases más precoces, para así cambiar la evolución natural de la enfermedad hacia el tratamiento con insulina exógena. La principal vía para conseguirlo son los medicamentos inmunomoduladores, que van dirigidos a modificar esa respuesta inmunológica anormal, paralizando así la destrucción de las células productoras de insulina.
En noviembre de 2022, la FDA (agencia de regulación de medicamentos de Estados Unidos), aprobó por primera vez el uso de Teplizumab para frenar la progresión de la diabetes en personas de más de 8 años de edad en estadio 2 de la enfermedad2.
Por todo ello, en los últimos años se están desarrollando estrategias para intentar diagnosticar a las personas con DM1 en las fases previas a la aparición de síntomas, para poder ofrecer un tratamiento que retrase la clínica de la enfermedad cuando esté disponible.
Estas estrategias pueden ir orientadas a buscar casos entre los familiares de primer grado de personas con DM1 (principalmente hijos, hermanos y padres de personas ya diagnosticadas). La principal desventaja de este tipo de estudios es que sólo un 15-20% de los nuevos casos de DM1 tienen antecedentes familiares de DM1, de forma que muchas personas no se verían beneficiadas por ello.
La otra forma de realizar el diagnóstico en etapas precoces sería el cribado o screening en población general, esto es, buscar en toda la población para encontrar esos casos en fases iniciales de la diabetes, antes de que tengan síntomas. Este tipo de estrategias tienen unos costes más elevados, pero su principal ventaja es que podrían detectar a muchas más personas que van a desarrollar la enfermedad.

La estrategia ideal de screening aún no existe, se está desarrollando principalmente a través de 2 vías. Una de ellas sería hacer estudio de auto-anticuerpos a todas las personas en algún momento determinado de su vida, principalmente en la infancia, que es donde suele iniciarse el proceso autoinmune, buscando el momento (edad) ideal donde más posibilidades hubiese de identificar a esas personas en riesgo, antes de presentar síntomas de diabetes. Otra vía sería hacer en un primer paso un estudio genético para identificar a las personas que tienen genética de riesgo de DM1, y, en esas personas de riesgo genético, hacer el estudio de auto-anticuerpos, de forma puntual o periódica.
EN LOS ÚLTIMOS AÑOS SE ESTÁN DESARROLLANDO ESTRATEGIAS PARA INTENTAR DIAGNOSTICAR A LAS PERSONAS CON DM1 EN LAS FASES PREVIAS A LA APARICIÓN DE SÍNTOMAS
En todo caso, las características propias de cada país, su sistema de salud pública, la variabilidad de la incidencia de la diabetes entre regiones y otros factores, hacen necesario que la forma de desarrollar estos programas de screening sea diferente en cada caso. Muchos países de nuestro entorno han empezado a investigar buscando el diseño óptimo de estas estrategias.
Así, el estudio ELSA (EarLy Surveillance for Autoimmune diabetes) en Reino Unido busca identificar a los niños en riesgo de desarrollar DM1 a través de un estudio de autoanticuerpos con una muestra de unas gotas de sangre obtenidas en el propio domicilio. También en Reino Unido se ha iniciado el proyecto T1DRA (Type 1 Diabetes Risk in Adults) para diagnosticar a adultos en fases presintomáticas de DM1.
El estudio Fr1DA en Alemania, también basado en la búsqueda de autoanticuerpos, en el que han participado más de 165.000 niños de la región de Bavaria, ha demostrado ya los beneficios del screening poblacional. En los niños diagnosticados dentro del programa, la incidencia de cetoacidosis diabética se redujo a un 2,5% (frente a un 25-40% habitual en países de nuestro entorno), y el diagnóstico de la enfermedad se acompañó de menores valores de HbA1c, glucemia en ayunas y mejores valores de función pancreática al diagnóstico.
SÓLO UN 15-20% DE LOS NUEVOS CASOS DE DIABETES DE TIPO 1 TIENEN ANTECEDENTES FAMILIARES DE DM1
En Finlandia, los proyectos DIPP y BABYSCREEN combinan el diagnóstico de riesgo genético de DM1 con el estudio de auto-anticuerpos en individuos de riesgo4.
El proyecto EDENT1FI (European action for the Diagnosis of Early Non-clinical Type 1 diabetes For disease Interception), lanzado en noviembre de 2023, fruto de la colaboración entre distintos investigadores y la industria y financiado a través de las organizaciones Innovative Health Inniative (IHI), Hemsley Charity Trust y Juvenil Diabetes Reseach Foundation (JDRF), realizará el screening de 200.000 niños en distintos países de Europa y tiene como objetivo evaluar el impacto psicosocial, médico y económico del cribado poblacional para contribuir a definir la mejor manera de realizar la detección precoz de la enfermedad y establecer las vías de tratamiento adecuadas en las fases iniciales.
En septiembre de 2023, Italia fue pionera en legislar un screening de DM1 y enfermedad celiaca dirigido a población general, que se debe desarrollar para que esté disponible a nivel nacional en los próximos años.
Otros países de nuestro entorno, como Portugal, Polonia, Italia, Bélgica, república Checa y Eslovenia están investigando y desarrollando sus propios programas de screening poblacional de DM1.
Dando un paso más, el proyecto europeo INNODIA investiga nuevos tratamientos que pudiesen frenar la aparición de diabetes tanto en familiares de personas con DM1 como en personas en las que ya se ha identificado autoanticuerpos específicos de diabetes, sin haberla desarrollado aún.
Conclusiones: Los programas de screening de DM1 ofrecen aún dudas en cuanto a su aplicabilidad, siendo necesario tener en cuenta los costes que es posible asumir y la necesidad de personal dedicado a su puesta en marcha. Como hemos explicado, aún no existen muchos tratamientos disponibles, y los que empiezan a aparecer, tendrán probablemente un coste elevado. El beneficio de mejorar el diagnóstico temprano de la DM1 en base a los síntomas iniciales cuando estos aparecen, ya está demostrado, pero para ello se requiere un adecuado asesoramiento, entrenamiento y acompañamiento de las familias de los niños diagnosticados en el screening, teniendo en cuenta también el impacto psicológico que pudiera producir en las familias la noticia de que ese niño aparentemente sano tiene alto riesgo de desarrollar diabetes en un futuro. Esperamos que en los próximos años los proyectos que ahora están en marcha nos ofrezcan respuestas, para seguir avanzando en el diagnóstico precoz y la prevención de la DM1.
BIBLIOGRAFÍA
- Ziegler AG, Rewers M, Simell O, Simell T, Lempainen J, Steck A, Winkler C, Ilonen J, Veijola R, Knip M, Bonifacio E, Eisenbarth GS. Seroconversion to multiple islet autoantibodies and risk of progression to diabetes in children. JAMA. 2013 Jun 19;309(23):2473-9.
- Herold KC, Bundy BN, Long SA, et al..; Type 1 Diabetes TrialNet Study Group . An anti-CD3 antibody, teplizumab, in relatives at risk for type 1 diabetes. N Engl J Med 2019; 381:603–613
- Hummel, S., Carl, J., Friedl, N., Winkler, C., Kick, K., Stock, J., Reinmüller, F., Ramminger, C., Schmidt, J., Lwowsky, D., Braig, S., Dunstheimer, D., Ermer, U., Gerstl, E. M., Weber, L., Nellen-Hellmuth, N., Brämswig, S., Sindichakis, M., Tretter, S., … Achenbach, P. (2023). Children diagnosed with presymptomatic type 1 diabetes through public health screening have milder diabetes at clinical manifestation. Diabetologia 2023; 66 (9), 1633–1642.
- Sims EK, Besser REJ, Dayan C, Geno Rasmussen C, Greenbaum C, Griffin KJ, Hagopian W, Knip M, Long AE, Martin F, Mathieu C, Rewers M, Steck AK, Wentworth JM, Rich SS, Kordonouri O, Ziegler AG, Herold KC; NIDDK Type 1 Diabetes TrialNet Study Group. Screening for Type 1 Diabetes in the General Population: A Status Report and Perspective. Diabetes. 2022 Apr 1;71(4):610-623.







