Distintas terapias modificadoras han cambiado la historia natural de diversas patologías autoinmunes. Sin embargo, la mayoría de las endocrinopatías autoinmunes, incluyendo la diabetes tipo 1 (DM1), siguen dependiendo de una terapia sustitutiva, con la que, a pesar de sus progresos, no siempre se alcanzan objetivos.
La DM1 es una enfermedad autoinmune de curso progresivo, que empieza tiempo antes, aunque variable, a su expresión clínica. La interacción entre factores genéticos y ambientales desempeña un papel crucial en el desarrollo de dicho proceso (Fig. 1). Sabemos, además, que existe un ataque autoinmune frente a la célula beta pancreática al menos 5 años antes de que aparezca clínica.
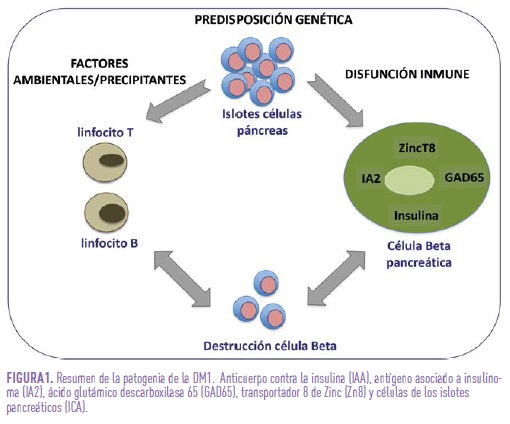
La Asociación Americana de Diabetes (ADA) reconoce tres estadios de la enfermedad: estadio 1 (positividad de > 2 auto-anticuerpos (AutoAc) frente a la célula beta pancreática con normalidad del metabolismo hidrocarbonado), estadio 2 (asintomático con > 2 AutoAc y “disglicemia”; esto es alteración en los niveles de glucosa en sangre, sin cumplir criterios de diabetes) y estadio 3 (criterios clínicos y/o bioquímicos de DM1). Algunos autores han centrado su atención en estadios clínicos precoces que aún no precisan insulina o bien, que necesitándola, todavía conservan una cierta reserva pancreática susceptible de ser conservada en el tiempo.
En los últimos 30 años se ha intensificado la búsqueda de nuevas terapias capaces de modificar el curso de la DM1, consiguiendo retrasar o incluso evitar la progresión a estadios clínicos y/o avanzados de la enfermedad, mostrando resultados muy prometedores que intentaremos resumir en este artículo. Mencionaremos también la necesidad creciente de hacer despistaje y diagnóstico precoz de las personas de riesgo y, eventualmente, la instauración de programas de screening poblacionales.
TEPLIZUMAB, LA PRIMERA OPCIÓN REAL EN EL MOMENTO ACTUAL PARA PACIENTES EN ESTADIO 2, PENDIENTE DE APROBACIÓN PARA SU USO EN ESTADIO 3
¿Cómo podemos estimar el riesgo de desarrollar DM1?
Para poder aplicar una terapia modificadora de la DM1 necesitamos detectar aquellos individuos en riesgo de desarrollarla o, con estadios precoces de la misma (estadio 2 principalmente).
Los AutoAc que surgen tras la pérdida de la tolerancia inmunológica y actúan frente a diferentes dianas relacionadas con la célula beta pancreática nos sirven de marcadores del curso de la enfermedad, siendo fundamentalmente AutoAc frente a: insulina (IAA), tirosina fosfatasa IA-2 (IA2), ácido glutámico descarboxilasa 65 (GAD65), transportador de Zinc 8 (ZnT8) y los islotes pancreáticos (ICA).
Diversos estudios de seguimiento de pacientes, así como población de riesgo (familiares sanos de pacientes con DM1) nos han permitido conocer la cronología de los distintos AutoAc y estadios de la DM1, así como el riesgo de desarrollarla, dependiendo del número y tipo de AutoAc positivos.
En estadio 1, con dos o más AutoAc positivos, el riesgo de desarrollar diabetes a los 5 años es del 44%, incrementándose a un 75% si tienes además “disglicemia”. El riesgo de evolucionar a estadio 3 en personas con 2 o más AutoAc de forma mantenida es de hasta el 70% a los 10 años y hasta el 88% a los 15 años, sobre todo si dichos AutoAc son IAA junto a IA2.
Existen también algunos sistemas de puntuación que incluyen el sistema de histocompatibilidad (HLA) y otras variantes no HLA, pero están menos desarrolladas a nivel clínico.
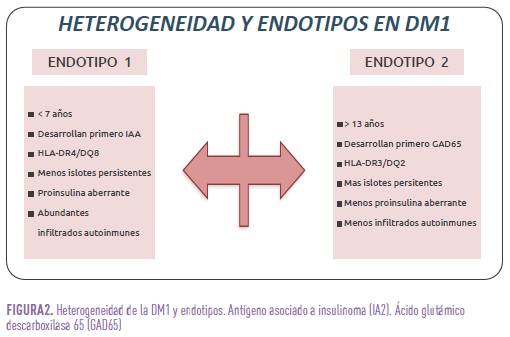
Por otra parte, cada vez se reconoce más la heterogeneidad de la DM1 (clínica, edad de inicio, ritmo de progresión, susceptibilidad a complicaciones, entre otros). Curiosamente, la velocidad a la que se pierde masa de células beta pancreáticas no es lineal y varía según los individuos, por lo que se habla de los distintos “endotipos”, así como endotipo 1 y endotipo 2. (Fig 2).
Nuevas terapias frenadoras de la progresión de la DM1
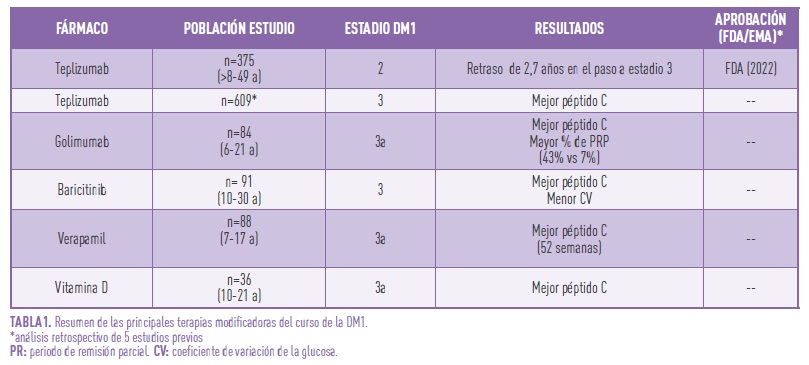
Una vez identificada la población de riesgo de evolucionar a estadios clínicos y/o avanzados, pasamos a comentar las nuevas terapias, centrándonos en las que están en fases más desarrolladas e incluso aceptadas por organismos reguladores oficiales. La mayoría de estas terapias han surgido como prevención secundaria (estadios 1 y 2) y terciaria (estadios 3 precoces). El mecanismo de acción se centra, en líneas generales, en la modulación de la respuesta autoinmune, estabilización y control de la apoptosis (muerte celular) de la célula beta pancreática, o bien, una combinación de las previas (Tabla 1).
Inmunomoduladores
En primer lugar, citaremos el teplizumab (anticuerpo monoclonal anti CD3) por estar en fase de estudio. Ya está aprobada por la FDA en estadio 2 para mayores de 8 años.
Distintos estudios preclínicos (en modelos animales) y clínicos han culminado con la aprobación de la primera terapia modificadora del curso de la DM1, el teplizumab (TZIELD, Provention, Bio, Inc, a Sanofi Company Red Bank, NJ), aprobado en Estados Unidos para su uso en esta indicación por la Food and Drug Administration (FDA). Dicho fármaco disminuye la respuesta inmune de los linfocitos T, responsables de gran parte de la patogenia de la DM1 y ha demostrado su capacidad de retrasar la progresión de DM1 en estadio 2 a estadio 3, en adultos y niños mayores de 8 años. Uno de los estudios clínicos más relevantes, ha mostrado cómo la administración durante 14 días de un ciclo de teplizumab en pacientes entre 8 y 49 años (el 78% de los pacientes tenían menos de 18 años) en estadio 2 es capaz de retrasar el paso a estadio 3 en casi 3 años. Además, el 50% de los pacientes tratados con el fármaco permanecieron libres de diabetes clínica a los 923 días, frente al 22% de los que habían recibido el placebo (controles). No obstante, todavía no existe la aprobación de la European Medicines Agency (EMA) para esta indicación.
Estudios posteriores, aunando resultados de 5 ensayos clínicos en estadio 3 de diabetes, han puesto de manifiesto que dicho tratamiento contribuye a preservar la funcionalidad de la célula beta pancreática, medida por los niveles de péptido C (marcador de producción endógena de insulina), con escasos efectos adversos. Es, por lo tanto, la primera opción real en el momento actual para pacientes en estadio 2, pendiente de aprobación para su uso en estadio 3. Existen estudios con otro anticuerpo humanizado anti-CD3 (otelixizumab), pero hasta el momento actual no han mostrado un perfil de eficacia y seguridad adecuado.

La administración de golimumab, un anticuerpo también humanizado frente a una citoquina mediadora de la respuesta autoinmune (factor de necrosis tumoral alfa, TNFα), en un grupo de pacientes (6-21 años) con diagnóstico reciente de DM1, ha demostrado que es capaz de preservar la producción endógena de insulina, sin efectos adversos significativos. Así mismo, describen un mayor porcentaje de pacientes en remisión parcial en el grupo tratado (43%) que en el grupo control (7%). Estos resultados, aunque alentadores, requieren más desarrollo para asegurar un perfil de eficacia y seguridad.
Otro gran grupo de productos en estudio son los moduladores de la co-estimulación del proceso autoinmune. Aquí se incluyen el abatacept (anticuerpo humanizado frente a un co-estimulador de la respuesta autoinmune -CTLA4 Ig-), con el que consiguen un mantenimiento temporal, de la capacidad de producir insulina endógena, con efectos adversos calificados como leves-moderados. Existen actualmente nuevos ensayos en marcha (NCT011773707), tratando de identificar distintos subgrupos de pacientes mejores “respondedores”, lo que podría estar relacionado con los distintos “endotipos” mencionados previamente.
Las terapias basadas en frenar la respuesta autoinmune de los linfocitos B, implicados también en la patogénesis de la DM1, están siendo igualmente objeto de estudio actual. Entre ellos se encuentran el rituximab, con resultados positivos en cuanto a la preservación de la capacidad de producir insulina endógena, pero también temporales (30 meses) y con algunos efectos adversos, que actualmente limitan su uso (depleción temporal de linfocitos B). La combinación secuencial de rituximab con abatacep es otra de las estrategias en estudio, de momento, sin resultados definitivos. Otra línea de investigación en fase clínica con terapias frente a los linfocitos B, evitando la depleción de los mismos, se está llevando a cabo con el iscalimab (anticuerpo humanizado anti CD-40), del que hay un ensayo en marcha en pacientes pediátricos y adultos jóvenes con debut reciente de DM1 (NCT04129528), pero sin resultados definitivos de momento.

Otras terapias en fases más iniciales de estudio incluyen la terapia celular con la administración de linfocitos T reguladores, encargados de mantener la tolerancia inmunológica periférica, procedentes de sangre periférica o cordón umbilical.
Baricitinib
Dentro del grupo de fármacos que bloquean la señal de las citokinas mediadoras de la respuesta autoinmune, se encuentra el baricitinib, utilizado para el tratamiento de la artritis reumatoide, entre otras entidades. Un estudio reciente de 2023 del grupo de la Juvenile Diabetes Research Foundation (JDRF), ha demostrado que su uso diario durante 48 semanas en pacientes con diagnóstico reciente de DM1, es capaz de preservar parte de la función de la célula beta pancreática. Aunque no encuentran diferencias entre el grupo tratado y el control en cuanto a niveles de HbA1c, si describen una mejoría en el coeficiente de variación de la glucosa (29,6% en tratados vs 33,8% en no tratados), probablemente relacionado con dicha preservación parcial de la funcionalidad de la célula beta.
Verapamil
En cuanto a fármacos aprobados para otras indicaciones, estudios preclínicos habían demostrado que los fármacos bloqueantes de los canales del calcio, como el verapamil, disminuían la expresión de una proteína que inducia la muerte de las células beta pancreáticas. Basándose en dichos estudios, el grupo de Forlenza, del centro Bárbara Davis, demuestra que el verapamil, en administración oral, diaria, es capaz de preservar la capacidad de producir insulina endógena a las 52 semanas. Se trata de un estudio multicéntrico, aleatorizado con 88 niños y adolescentes con diagnóstico de DM1 en los 31 días previos. Aunque podría ser un fármaco prometedor, con un perfil de seguridad adecuado, no está todavía admitido por las autorizadas reguladoras (FDA/EMA) para esta indicación.
Vitamina D
En relación con la administración de vitamina D, recientemente se ha publicado un estudio controlado y aleatorizado, en pacientes, con DM1 de reciente diagnóstico, en el que describen mejoría en el mantenimiento de la reserva pancreática, medida por los niveles de péptido C estimulado, tras tratamiento con dosis altas de vitamina D. Apoyan sus resultados con determinación de los niveles de una citoquina proinflamatoira (TNF-α), siendo éstos significativamente inferiores en el grupo de tratados. No obstante, el estudio se ha realizado en un número muy reducido de pacientes y se necesitan más estudios confirmatorios.
Análogos del receptor del péptido 1 similar al glucagón (AGLP-1R)
Recientemente, algunos estudios han sugerido que los AGLP-1R, indicados hasta ahora para la diabetes tipo 2 (DM2), podrían contribuir a la estabilización de la célula beta pancreática, preservando su funcionalidad, reduciendo el estrés metabólico y previniendo la muerte celular. Así, han surgido algunos estudios con muy escasos pacientes (n=10) con diagnóstico reciente de DM1, que parecen apoyar que el semaglutide contribuye a la preservación de la capacidad de producir insulina endógena. No obstante, se necesitan estudios más amplios, prospectivos y randomizados que confirmen dicha aproximación terapéutica. Con el mismo propósito de mantener la masa de células beta, otros autores han combinado dosis bajas de una citokina, concretamente interleuquina 21, con un AGLP-1R (liraglutide). Aunque describen resultados iniciales positivos, enlenteciendo la funcionalidad de la célula beta, el efecto cesa cuando se termina el tratamiento.

Retos y futuras líneas de investigación
El desarrollo de las nuevas terapias modificadoras del curso de la DM1 está cambiando radicalmente la aproximación terapéutica de la DM1, liderado por las terapias inmunomoduladoras, sin olvidar los fármacos dirigidos a estabilizar y disminuir el estrés celular de la célula beta pancreática. Paralelamente surgen también nuevos retos, como la heterogeneidad de la diabetes y la necesidad de sistemas de despistaje ágiles y precisos. Dichas terapias auguran, sin ninguna duda, un nuevo futuro para los pacientes con DM1, más allá del tratamiento sustitutivo.
Bibliografia
- Frohnert BI, Ghalwash M, Kenney Ng YL, Dunne JL, Lundgren M, Hagopian W y cols. T1DI Study Group. Refining the Definition of Stage 1 Type 1 Diabetes: An Ontology-Driven Analysis of the Heterogeneity of Multiple Islet Autoimmunity. Diabetes Care 2023;46(10):1753–1761. https://doi.org/10.2337/dc22-1960
- Thompson PJ, Pipella J, Rutter GA, Gaisano HY y Santamaria P. Islet autoimmunity in human type 1 diabetes: initiation and progression from the perspective of the beta cell. Diabetologia 2023; 66:1971–1982. Doi.org /10.1007/s00125-023-05970-z.
- Tatovic D, Parth Narendran P y Dayan CM. A perspective on treating type 1 diabetes mellitus before insulin is needed. Nature Reviews Endocrinology 2023;19: 361–370. Doi.org/10.1038/s41574-023-00816-5
- Limbert C, Von dem Berge T y Danne T. Personalizing Early-Stage Type 1 Diabetes in Children. Diabetes Care 2023;46:1747–1749. Doi.org/10.2337/dci23-0025
- Schweiger DS. Recent advances in Inmune-based therapies for type 1 diabetes. Horm Res Pediatr2023;96:631-645.
- Herold KC, Gitelman SE, Gottlieb PA, Knecht LA, Raymond R, y Ramos EL. Teplizumab: A Disease-Modifying Therapy for Type 1 Diabetes That Preserves b-Cell Function. Diabetes Care 2023;46(10):1848–1856. Doi.org/10.2337/dc23-0675
- Ramos E, Dayan CM, Chatenoud L, SumniK Z, Simmons KM, Szypowska A, Gitelman SE y cols; PROTECT Study Investigators. Teplizumab and β-Cell Function in Newly Diagnosed Type 1 Diabetes. N Engl J Med 2023;389(23):2151-2161. Doi: 10.1056/NEJMoa2308743.
- Michaela Waibel, M,Wentwoth JM, So M, Couper JJ, Cameron FJ, Macisaac RJ, Atlas G y cols; BANDIT Study Group. Baricitinib and β-Cell Function in Patients with New-Onset Type 1 Diabetes. N Engl J Med 2023 Dec 7;389(23):2140-2150. Doi: 10.1056/NEJMoa2306691.
- Forlenza GP, McVean J, Beck RW, Bauza C, Bailey R, Buckingham B y cols. CLVerStudy Group. JAMA 2023;329(12):990-99.Doi:10.001/jama.2023.2064
- Harris E. Semaglutide Associated With Less Insulin Need in Early Type 1. JAMA 2023;330(14):1318. Diabetes. September 20, 2023. Doi:10.1001/jama.2023.17823.
- Mathieu CH, Wiedeman A, Cerosaletti K, Long SA, Serti E, Cooney L et al. A first-in-huma, open-label Phase 1b and a randomized, double-blind Phase 2a clinical trial in recente-onset typ1 1 diabetes with AGO19 as monotherapy and in combination with teplizumab. Diabetologia 2024;67:27-41.
- Simmons K, Frohnert BI, O´Donnell HK, Bautista K, Rasmussen CG, Gonzalez AG et al. Historial Insights and Current Perspectives on the Diagnosis and Management of presymptomatiic Type 1 Diabetes. Diabetes Technology & Therapeuticas 2023;25(11):790-799







