¡Ya llegan! ¡Por fin dispondremos de fármacos útiles y seguros para el manejo de la obesidad! Obesidad ¿pero no hablamos de diabetes?
La obesidad es un factor de riesgo importante para el desarrollo de diabetes mellitus tipo 2 (DM2), y la DM2 puede conducir a obesidad. El 70-80% de los pacientes con DM2 tienen sobrepeso u obesidad. La epidemia que tenemos de obesidad en todo el mundo se solapa con la epidemia de DM2, siendo un problema en el mundo occidental, las predicciones indican que va a ser mucho peor en los países en desarrollo1. Si conseguimos reducir las tasas de obesidad, se reducirán las tasas de aparición de nuevos casos de diabetes y los pacientes ya con diabetes mejorarán. Cuando un paciente con DM2 logra perder peso es frecuente que haya mejoría en la analítica: se reducen los niveles de glucosa, hemoglobina glicada (HbA1c), colesterol, triglicéridos, ácido úrico, transaminasas… Los análisis casi parecen de otro paciente, pero además la capacidad funcional del paciente mejora, se siente mejor.
La población general relaciona a los endocrinólogos con el tratamiento de la obesidad y algunos nos relacionan además con la diabetes o “las hormonas”. Es correcta esa apreciación ya que muchos de nuestros pacientes sufren obesidad. La obesidad es una enfermedad crónica y multifactorial, que se caracteriza por un exceso de grasa corporal. Una enfermedad muchas veces ignorada. Aunque pueda ser evidente sólo con ver al paciente, lo que no se mide no existe. Si no se refleja en la historia clínica o en el informe médico, no existe. En la mayoría de las historias clínicas figuran signos vitales como tensión arterial, frecuencia cardiaca, temperatura… pero no figura el peso o la talla del paciente, y mucho menos el perímetro de cintura. Cuando leemos el informe de un paciente y vemos el listado de los antecedentes personales, es frecuente leer hipertensión, hipercolesterolemia, asma, antecedentes quirúrgicos y obstétricos, pero no suele figurar obesidad y, si aparece, no figura el grado o las limitaciones que suponen para el paciente. La obesidad raramente aparece sola, suele acompañarse de otras enfermedades como hipertensión arterial, dislipemias, DM2, cardiopatía isquémica, accidentes vasculares cerebrales, litiasis vesicular, artropatías, ovario poliquístico, apnea del sueño o incluso algunos tipos de cáncer (colorrectal, mama, endometrio y próstata)2. Además de ser ignorada, es una patología maltratada a todos los niveles por las autoridades sanitarias, los propios profesionales sanitarios y por la propia sociedad. Son habituales las asociaciones de diabetes, pero no tanto las de obesidad. Desde hace unos años se intenta luchar contra el estigma que acompaña a esta enfermedad.
Volviendo a la diabetes, hace no muchos años el tratamiento de la DM2 contaba para su tratamiento con 2 fármacos: sulfonilureas y metformina; y la DM1, un fármaco: la insulina. En las últimas 2 décadas hemos asistido a cambios muy importantes en el manejo de esta enfermedad. Hoy disponemos para tratar la DM2 de muchos fármacos pertenecientes a distintas familias que actúan a distintos niveles. Unos pacientes responden mejor a unos que a otros. La tolerancia y la eficacia varía. Todos, en mayor o menor grado, reducen los niveles de glucosa en sangre, pero su efecto sobre el peso es distinto. Algunos favorecen el aumento de peso (sulfonilureas, glitazonas, insulina), otros no tienen impacto sobre el peso (iDPP4 -inhibidores de la dipeptidil peptidasa 4) y otros favorecen la pérdida de peso (iSGLT2 -inhibidores del cotransportador de sodio-glucosa tipo 2 y arGLP-1- agonistas del receptor del péptido similar al glucagón tipo 1).
La mayoría de los tratamientos se administran por vía oral, aunque disponemos de una familia, los arGLP-1, que se pueden además inyectar vía subcutánea, igual que la insulina. La administración puede ser desde 2 veces al día a una vez a la semana.
Los arGLP-1 más potentes en cuanto a reducción de peso han alcanzado la fama este último año: se han convertido en estrellas, han saltado de la literatura científica a trending topic en redes sociales; han aparecido en artículos de revistas y periódicos; se ha hablado de ellos en tertulias, hasta en el telediario… Es la primera vez que los pacientes se apuntan en listas de espera en las farmacias para conseguir un fármaco. La demanda ha desbordado todas las predicciones y llevamos un año con problemas de abastecimiento.
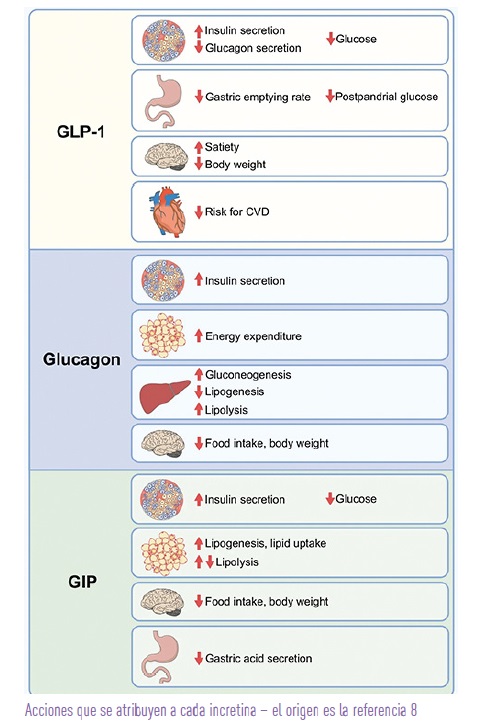
Empecemos por el principio. Los arGLP-1 se desarrollan a partir del descubrimiento del efecto incretina, que define una mayor producción de insulina cuando la glucosa se administra por boca (la vía normal de ingesta) frente a la administración intravenosa (vía artificial). Es decir, el cuerpo, cuando recibe nutrientes que llegan al intestino, avisa al páncreas para que produzca más insulina y aproveche esos nutrientes3. Ese “algo” que avisa al páncreas son hormonas gastrointestinales que hemos llamado incretinas. Las más importantes son GLP-1 (péptido similar al glucagón tipo 1) y GIP (péptido insulinotrópico dependiente de glucosa). Esto es lo que ocurre en la fisiología normal. En los pacientes con DM2 ese aviso es menor o ni siquiera hay aviso. Los niveles de GLP-1 tras la ingesta están reducidos. Los niveles de GIP son normales, pero su acción es menor4. Cuando se ha intentado administrar GIP a los pacientes con DM2, no se ha observado mejoría. En cambio, administrar GLP-1 corrige parte del defecto, pues avisa al páncreas para que produzca insulina. Para mejorar la glucemia en DM2 lo que se busca es restaurar la producción adecuada de insulina5.
LOS EFECTOS DE LOS ARGLP-1 VAN MÁS ALLÁ DE SU ACCIÓN SOBRE EL PÁNCREAS AUMENTANDO LA PRODUCCIÓN DE INSULINA Y REDUCIENDO LA DE GLUCAGÓN. SE HAN ENCONTRADO RECEPTORES PARA GLP-1 EN MUCHOS TEJIDOS COMO CEREBRO, CÉLULAS INMUNITARIAS, INTESTINO O RIÑÓN, DANDO LUGAR A EFECTOS EXTRAPANCREÁTICOS
El problema es que el GLP-1 sólo se puede administrar por vía endovenosa en infusión continua ya que su efecto apenas dura unos minutos. Para resolverlo se han desarrollado fármacos de estructura más o menos similar al GLP-1 nativo, que actúan sobre el receptor de GLP-1 de forma duradera al administrarlos por vía subcutánea. El primer análogo comercializado, hace unos 15 años, fue exenatida. Ha sido muy superado y prácticamente ya no se utiliza. Se administra 2 veces al día por vía subcutánea y tiene 2 dosis, 5 y 10 mcg. Debe iniciarse con la dosis baja y aumentarla posteriormente. Esto es común a toda esta familia de fármacos, para evitar los efectos adversos. Primero se busca tolerancia; luego, eficacia. Los efectos adversos comunes a toda la familia son fundamentalmente gastrointestinales. Lo más común, las náuseas. También vómitos y diarrea (sobre todo cuando no se instruye al paciente a seguir las recomendaciones nutricionales de hacer ingestas pequeñas y bajas en grasa, o el paciente se las salta), o estreñimiento.
Otros análogos posteriores fueron lixisenatida y liraglutida, ambos de administración única diaria, y otros los de administración semanal: albiglutida, exenatida LAR, dulaglutida y semaglutida. Unos han desbancando a otros y actualmente usamos liraglutida, dulaglutida y semaglutida, esta última puede administrarse semanalmente vía subcutánea o vía oral.
Los efectos de los arGLP-1 van más allá de su acción sobre el páncreas aumentando la producción de insulina y reduciendo la de glucagón. Se han encontrado receptores para GLP-1 en muchos tejidos como cerebro, células inmunitarias, intestino o riñón, dando lugar a efectos extrapancreáticos.
La familia de los arGLP-1 son los fármacos más caros entre las distintas opciones de tratamiento para la DM2. La sanidad pública, que tiene que hacer un uso racional de los recursos disponibles, decidió restringir su financiación a pacientes con DM2 mal controlada (HbA1c>7%) y obesidad (definida como índice de masa corporal superior a 30 kg/m2). En años posteriores a su comercialización se han publicado estudios que han demostrado beneficio cardiovascular en DM2, con independencia del peso basal del paciente, e incluso sin que el paciente pierda peso de forma significativa. Es decir, que el mecanismo por el que producen beneficio cardiovascular es al menos en parte independiente de la pérdida de peso lograda. Las sociedades médicas se han posicionado a favor de su financiación en pacientes DM2 que han sufrido un evento cardiovascular, pero la financiación de momento no ha cambiado. Además, en noviembre de 2023 se publica un estudio con dosis altas de semaglutida demostrando beneficio cardiovascular en pacientes obesos sin DM26. Esta evidencia podría abrir la puerta a la financiación pública ya que, al prevenir las complicaciones de la diabetes y la obesidad, se podría reducir el gasto sanitario.
A día de hoy, los arGLP-1 están posicionados como una clase terapéutica para el tratamiento de la DM2, con potencia similar o superior a la insulina para reducir los niveles de HbA1c, que favorece la pérdida de peso y previene eventos cardiovasculares. Así se describen en las principales guías de tratamiento de la DM2, y se recomienda su uso desde fases tempranas de la enfermedad, especialmente si el paciente ya presenta un evento cardiovascular o muy alto riesgo de tenerlo. Se recomienda como primer fármaco inyectable, antes de usar insulina7. Se están realizando estudios para valorar su impacto en la enfermedad microvascular como la nefropatía diabética, la disfunción metabólica asociada a la esteatosis hepática o la demencia. A pesar de ser una revolución en el tratamiento de la DM2, el porcentaje de pacientes con DM2 que recibe estos fármacos no suele superar el 15% en los distintos países europeos.
Volviendo al tema de la fama… además de mejorar el control glucémico, enlentecen el vaciamiento gástrico produciendo saciedad y tienen efecto anorexígeno a nivel cerebral. Con la primeros arGLP-1, algunos pacientes perdían peso de forma muy significativa, unos 10-14 kg. La respuesta en relación al peso es muy variable y no tenemos ningún marcador para identificar qué paciente va a perder peso y quién no, ni cuánto. Con los fármacos más potentes, el número de pacientes que tienen pérdidas de peso muy significativas ha ido aumentando y los Kg perdidos también. La pérdida de peso es un incentivo para que los pacientes sigan el tratamiento, mejorando la adherencia, que habitualmente es baja en enfermedades crónicas. En algunos casos, la pérdida de peso con los arGLP-1 ha sido tan significativa que ha supuesto un cambio positivo en la vida de los pacientes, mejorando su autoestima y su calidad de vida.
Como anécdota de la consulta podemos contar que es habitual, al atender a un paciente con DM2 usando estos fármacos, que su acompañante con obesidad y sin DM2 preguntara si podía usar el fármaco. Esa misma pregunta se la han hecho los laboratorios que desarrollan estos fármacos y se han diseñado programas de investigación específicos para obesidad en pacientes sin DM2. Para nuestra sorpresa, las pérdidas de peso son al menos un 50% superiores con respecto a pacientes con DM2, lo que ha abierto la puerta a una terapia eficaz contra la obesidad. Se ha especulado por qué los pacientes con DM2 responden peor. No hay respuesta clara aún, pero es posible que la respuesta esté en los mecanismos compensadores que tiene la DM2.
Se ha descrito que existe comunicación entre el intestino y el cerebro a través de las incretinas. La acción de estas moléculas sobre receptores a nivel cerebral favorece la pérdida de peso. Los arGLP-1 de los que disponemos hasta ahora son monoagonistas, es decir, actúan sólo sobre el receptor de GLP-1, activándolo. La investigación ha acabado desarrollando los poliagonistas. Son moléculas que actúan a la vez sobre varios receptores incretínicos, fundamentalmente GLP-1, GIP y glucagón, logrando mayor eficacia con similar o mejor tolerancia.
El doctor Matthias Tschöp recibió en 2023 la medalla Banting, otorgada por la Asociación de Diabetes Americana (ADA), por sus investigaciones en el desarrollo de estas moléculas. En su exposición indicaba como la sucesión de monoagonistas, agonistas duales y posteriormente triagonistas lograrán cubrir el espacio que separa el tratamiento con dieta y ejercicio, que logra pérdidas en torno al 5-10% del peso, y la cirugía bariátrica, que logra pérdidas en torno al 30% del peso. Además, planteaba un futuro con desarrollo de moléculas con distintos perfiles que permita una medicina personalizada en el tratamiento de la DM2 y obesidad8.
El desarrollo está siendo vertiginoso. Aún no tenemos la primera generación comercializada y ya vemos otras estrellas nacientes que acabarán eclipsando (al menos parcialmente) a las que ahora van a brillar.
El primer poliagonista dual desarrollado fue cotadutida (análogo de GLP-1 y glucagón), molécula de administración subcutánea diaria que ni siquiera llegará al mercado porque ya ha sido superada por otras moléculas de administración semanal y más potentes. Lograba, en pacientes con DM2, pérdidas de peso algo superiores a los monoagonistas actuales, aumentando ligeramente el número de pacientes que conseguía alcanzar HbA1c menores de 6.5% (nivel a partir del cual podemos considerar remisión de la diabetes). En la misma línea, se está desarrollando survodutida, también agonista dual de GLP-1 y glucagón de administración semanal. En junio de 2023 se presentaron los resultados de los estudios fase 2 en pacientes con obesidad, sin DM2, consiguiendo pérdidas de peso de casi un 20% en menos de un año sin que haya llegado a su máximo efecto. Aún le quedan unos años para que lo tengamos disponible9. Mazdutida, otra molécula similar, también semanal, está en fases más precoces de desarrollo. El equilibrio en el grado de agonismo sobre cada receptor parece la clave para el éxito de estas moléculas. Si su efecto sobre el receptor de glucagón es pobre en relación al receptor de GLP-1, la pérdida de peso no es mucho mayor que la de un monoagonista de GLP-1; y, si es al revés, puede hacer que la mejora glucémica sea escasa.
La próxima estrella que se espera se comercialice en 2024 es tirzepatida. Es el primer fármaco unimolecular agonista dual sobre GLP-1 y GIP. Tiene la misma potencia sobre el receptor de GIP que el GIP nativo, mientras que sobre el receptor de GLP-1 es 5 veces menos potente. En DM2, los datos publicados de pérdida de peso (15%) casi doblan a la que se logra con semaglutida 1.0 mg (la dosis máxima que usamos actualmente). El número de pacientes que pierde peso es muy elevado, casi desaparecen los pacientes no respondedores. La mejora de la HbA1c es del 2% frente a placebo. Frente a semaglutida, la mejora es de 0.5%. No es tan llamativa, pero es que muchos pacientes no podían mejorar más por estar en normoglucemia. Lo que sí aumenta es el número de pacientes que logra el objetivo de HbA1c <7% (90%), <6.5% (85%), o incluso <5.7% (55%), partiendo de HbA1c en torno a 8%.
En el horizonte está el primer triple agonista que actúa sobre GLP-1, GIP y Glucagón: retatrutida. Los resultados de los estudios fase 2 en sólo 32 semanas (sin llegar a la estabilización de resultados) mejoran mucho el efecto en pérdida de peso que consigue tirzepatida en DM2 obesos. El 60% de los pacientes logra perder más de un 15% de su peso (frente al 40% con tirzepatida). Con respecto a la HbA1c, el 80% de los pacientes logra el objetivo de <6.5% y hasta un 30% de <5.7%. Aún son más espectaculares los resultados en obesidad, con pérdidas medias de 24% del peso en 48 semanas (sin haber llegado a la estabilización). Hasta un 26% de los pacientes logró perder el 30% de su peso, similar a lo que se logra con cirugía bariátrica.
La investigación en el campo de las incretinas no sólo se ha centrado en el desarrollo de poliagonistas. Hay otras aproximaciones farmacológicas en desarrollo en distintas fases, moléculas pequeñas que activan los receptores de GLP-1, secretagogos de GLP-1, algunos subcutáneos habitualmente semanales y orales de administración diaria. Los objetivos también se han ampliado a DM2, obesidad, hígado graso… El futuro cercano promete tratamiento seguro y eficaz para la obesidad y, por tanto, sus comorbilidades: DM2, hipertensión, dislipemias, apnea del sueño, artropatías… Tendremos que aprender a manejar estos fármacos y buscar el perfil adecuado para cada paciente.
Bibliografía:
- Bhupathiraju S. Epidemiology of Obesity and Diabetes and Their Cardiovascular Complications. Circ Res. 2016 May 27; 118(11): 1723–1735.
- Lorenzo. Why primary obesity is a disease? J Transl Med. 2019 May 22;17(1):169
- Creutzfeldt W (1979). The incretin concept today. Diabetologia 16(2):75–85. Diabetologia 16(2):75–85
- Nauck M, Stockmann F, Ebert R, Creutzfeldt W (1986) Reduced incretin effect in type 2 (non-insulin-dependent) diabetes. Diabetologia 29:46–52.
- Nauck MA, Müller TD. Incretin hormones and type 2 diabetes (2023). Diabetologia
- Semaglutide and Cardiovascular Outcomes in Obesity without Diabetes. N Engl J Med. 2023 Nov 11. doi: 10.1056/NEJMoa2307563. Online ahead of print.
- Davies MJ, Aroda VR, Collins BS et al (2022) Management of hyperglycaemia in type 2 diabetes, 2022. A consensus report by the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetologia 65:1925–1966
- Tschöp M, Nogueiras R, Ahrén B (2023) Gut hormone-based pharmacology: novel formulations and future possibilities for metabolic disease therapy. Diabetologia.
- Le Roux C et al. Diabetes 2023;72(Supplement_1):51-OR