La incidencia de diabetes está aumentando en todo el mundo, y casi la mitad de los casos permanecen sin diagnosticar. El estudio transversal Di@bet.es ya mostró, en una muestra representativa de la población española, el elevado número de personas con diabetes y prediabetes desconocidas (1). Un control deficiente de los niveles de glucosa provoca complicaciones vasculares, que son la principal causa de morbilidad asociada a la enfermedad. Los métodos actuales de diagnóstico de los trastornos metabólicos proporcionan pocas pistas sobre la etiología de la enfermedad o sobre su evolución posterior y la incidencia de complicaciones. La detección temprana de los individuos afectados permitiría implementar terapias oportunas y efectivas.
LAS VESÍCULAS EXTRACELULARES CIRCULANTES EN LA SANGRE HAN SURGIDO COMO UNA FUENTE DE NUEVOS BIOMARCADORES PARA EL DIAGNÓSTICO Y LA PREDICCIÓN DE LAS COMPLICACIONES DE LA DIABETES
Biomarcadores en diabetes.
Los biomarcadores son moléculas o modificaciones de éstas que señalan la existencia de una enfermedad y de sus complicaciones asociadas, al mismo tiempo que permiten predecir el riesgo de padecer la enfermedad o su progresión. Uno de los objetivos del uso de biomarcadores moleculares es la detección de la enfermedad en una etapa primaria, lo que puede favorecer una intervención lo más temprana posible. También es muy importante encontrar biomarcadores moleculares que puedan predecir la progresión de la enfermedad y la eficacia de un tratamiento, lo que permitiría un tratamiento personalizado. Para que un biomarcador sea de máxima utilidad tiene que cumplir que sea específico, sensible, predictivo y no invasivo. En general, los biomarcadores son moléculas que se encuentra en fluidos corporales (como la sangre) o tejidos de fácil acceso.
La glucosa en ayunas, la glucosa a las 2 horas después de una sobrecarga oral con glucosa y la hemoglobina glicosilada (HbA1c) son marcadores glucémicos que se utilizan para diagnosticar la diabetes y para el control de la glucemia en pacientes con diabetes, y que podríamos considerar como los biomarcadores “clásicos”. La presencia de anticuerpos contra proteínas de las células beta pancreáticas también pueden considerarse como biomarcadores para la diabetes tipo 1 (DM1). La insulina en ayunas refleja una combinación de secreción de insulina y resistencia a la insulina, los cuales son componentes de la diabetes tipo 2 (DM2), reflejando también el aclaramiento de insulina. En las últimas dos décadas han surgido nuevos marcadores basados en técnicas de genómica. Aunque se ha demostrado cierto grado de heredabilidad en la DM2, los locus de riesgo identificados con la llegada de los estudios de asociación genética global (GWAS) explican solo un bajo porcentaje de casos. Por lo tanto, a excepción de los casos monogénicos de diabetes, el uso de la genética o de los cambios epigenéticos en células de la sangre para predecir el desarrollo o la progresión de la enfermedad metabólica aún presenta muchas limitaciones.
Los microRNAs como nuevos biomarcadores.
Los microRNAs (o miRNAs) pertenecen al grupo de RNAs que conocemos como no codificantes (non-coding RNAs). Se denominan así porque no codifican para una proteína, pero ahora se sabe que desempeñan funciones esenciales. En concreto, los microRNAs son moléculas pequeñas de RNA de cadena simple, normalmente de unas 20-23 bases, y que tienen una función reguladora sobre la traducción de una molécula de RNA mensajero (mRNA) a proteína. Hoy en día se conocen centenares de microRNAs distintos en los mamíferos, y cada uno de ellos se unen a los extremos 3’UTR de mRNAs específicos (llamados dianas), ejerciendo su función de dos maneras: impidiendo la traducción de la proteína por los ribosomas, o induciendo la degradación del mRNA.
Los microRNAs están codificados por genes y ejercen su acción en el interior de las células. Como otros genes, su expresión se ve alterada en distintos tejidos en personas y animales con diabetes o con el metabolismo de la glucosa alterado (2). El interés de estos microRNAs experimentó un fuerte repunte cuando se encontraron microRNAs en la sangre (microRNAs circulantes). Hace ya más de una década que ganó fuerza la posibilidad que los microRNAs circulantes en sangre podrían ser biomarcadores de la diabetes, tanto para su diagnóstico como para identificar personas con riesgo de desarrollarla (3). Hoy en día, existe una amplia variedad de kits comerciales para el aislamiento de los microRNAs tanto de tejido como de plasma o suero. Al ser los microRNAs secuencias de RNA pequeñas, su identificación puede realizarse mediante PCR cuantitativa y actualmente varias compañías comerciales ofrecen ensayos para el análisis de la expresión de centenares de microRNAs de una misma muestra. Pero los avances de la genómica, y en concreto de la secuenciación de nueva generación, ya permiten cuantificar el conjunto de moléculas de ARN (incluidos los microRNAs y otros ARNs no codificantes), lo que va a facilitar la identificación de nuevos biomarcadores de una forma más rápida y efectiva, así como su validación en distintas cohortes.
Distintos estudios transversales han revelado un aumento de algunos microRNAs y una disminución de otro conjunto de microRNAs en pacientes con DM2 y prediabetes (4, 5). Es importante señalar que el perfil de los microRNAs en pacientes prediabéticos y con diabetes es distinto, lo que puede ayudar a discriminar los pacientes en distintos estados de la enfermedad. Además, estudios longitudinales han revelado también cambios en los niveles de ciertos microRNAs en un seguimiento a lo largo de un tiempo (permitiendo encontrar una correlación de microRNAs con la incidencia de la diabetes o de complicaciones derivadas), así como en respuesta a un tratamiento farmacológico (por ejemplo, la metformina) o a una intervención sobre el estilo de vida (por ejemplo, la implementación de un programa de ejercicio). Estos datos muestran el potencial de los miRNAs circulantes como biomarcadores de diagnóstico de prediabetes y de monitorización de un tratamiento.
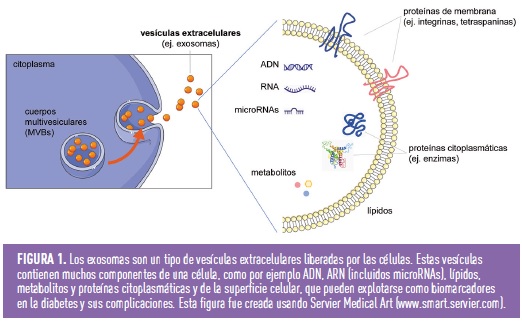
Las vesículas extracelulares como fuente de nuevos biomarcadores en diabetes
Todas las células liberan vesículas membranosas denominadas genéricamente como vesículas extracelulares (VEs) como parte de su fisiología normal. En función de su biogénesis, las VEs se pueden clasificar en cuerpos apoptóticos, microvesículas y exosomas. Los exosomas son VEs con un rango de tamaño de ~40 a 160 nm de diámetro (promedio ~100 nm) con un origen endosómico. Los exosomas se forman cuando la membrana de los endosomas primarios se invagina, engullendo una porción del citoplasma y fusionándose con otras vesículas y orgánulos intracelulares, lo que contribuye a la diversidad en los constituyentes de los exosomas, dando lugar a un cuerpo multivesicular (MVB). Estos MVB se fusionan con los lisosomas para reciclar los componentes celulares, pero algunos de ellos se fusionan con la membrana plasmática y liberan los exosomas al medio extracelular. Dependiendo de la célula de origen, las VEs, incluidos los exosomas, pueden contener muchos componentes de una célula, como por ejemplo ADN, ARN, lípidos, metabolitos y proteínas citosólicas y de la superficie celular. Es difícil obtener preparaciones puras de exosomas o microvesículas, ya que sus tamaños se superponen y no existen buenos marcadores proteicos específicos. Por este motivo, la mayoría de los estudios que se centran en exosomas o microvesículas analizan poblaciones de vesículas mixtas, usando el término genérico de vesículas extracelulares (VEs).
Las VEs desempeñan una función en la comunicación intercelular al intercambiar la carga que llevan entre células vecinas de un mismo tejido, pero también entre tejidos y órganos distantes. Al ser liberadas por las células, las VEs llegan con mayor o menor medida al torrente circulatorio, de manera que su presencia en la sangre puede ser un indicador de ciertas patologías y la carga que llevan puede ser cuantificada mediante técnicas de biología molecular, siendo los microRNAs seguramente las moléculas más estudiadas con esta finalidad. Durante los últimos años se ha acelerado la investigación de las VEs como fuente de biomarcadores de riesgo de desarrollar DM2. En estudios longitudinales en pacientes inicialmente diagnosticados con prediabetes, se han identificado microRNAs en las VEs cuyos niveles son capaces de discriminar las personas a las que se diagnostica DM2 al cabo de unos años de seguimiento (6). El hecho que, en general, el perfil de los microRNAs de las VEs de los sujetos prediabéticos que progresan a diabetes manifiesta sea más similar al de los pacientes con diabetes que al perfil de los sujetos prediabéticos que no progresan a diabetes indica que estos biomarcadores se anticipan a los marcadores bioquímicos usados para la diagnosis de la diabetes franca. Estos biomarcadores podrían por tanto implementarse para identificar sujetos con prediabetes con alto riesgo de desarrollar DM2.
El estudio de las VEs circulantes es aún muy incipiente, y seguramente estamos simplificando mucho su relevancia en la sangre, donde se encuentran VEs liberadas por todos los órganos del organismo. La falta de especificidad tisular, entre otras razones, dificulta su interpretación clínica. Por tanto, uno de los aspectos donde se tendrá que incidir en los próximos años es la identificación de subgrupos de VEs en función de su origen y de la condición fisiológica que provoca los cambios en sus niveles. Esto será esencial para encontrar la etiología de la enfermedad, los mecanismos de comunicación entre órganos y para identificar las células que se encuentran afectadas en un estado patológico. Una estrategia que ya se está usando es la de purificar VEs mediante anticuerpos específicos para proteínas de membrana específicas de distintos subgrupos de VEs y que en muchas ocasiones viene determinado por el tejido de origen. Por ejemplo, se han identificado microRNAs afectados en las VEs circulantes que expresan CD31 en pacientes con DM2 y que se han propuesto como una herramienta potencial para detectar complicaciones cardiovasculares de la DM2 (7).
En referencia a la DM1, se ha descrito que los islotes humanos tratados con citoquinas inflamatorias liberan VEs enriquecidas en microRNAs que también se han encontrado aumentados en el suero de personas con DM1 y ratones NOD (un modelo de DM1), por lo que podrían actuar como un posible biomarcador (8). Otros estudios han identificado microRNAs cuyos niveles se encuentran aumentados o reducidos en los exosomas aislados de personas con DM1 de larga duración (9). En estos casos, ya se ha diagnosticado la diabetes y por lo tanto ya existe muy poco o nada de remanente de célula beta. Será interesante seguir estudiando este aspecto por si podemos encontrar biomarcadores de destrucción de célula beta cuando aún existe una carga celular suficiente y sin sintomatología evidente.
Se espera que en los próximos años se irá conociendo con más detalle la biología de las VEs. La aplicación de la metabolómica para la identificación integral de moléculas pequeñas, incluidos aminoácidos, carbohidratos, lípidos, péptidos y ácidos orgánicos, entre otros, así como de la proteómica para la identificación de proteínas serán esenciales para encontrar biomarcadores en las VEs. En este sentido, las cada vez más sensibles técnicas de proteómica han permitido encontrar cambios en proteínas y fosfoproteínas en las VEs a lo largo del espectro de la DM2 (10). Las diferencias encontradas entre muestras procedentes de personas con prediabetes y DM2 pueden ser la base del desarrollo de los eventos tempranos patogénicos que conducen a la diabetes y a sus co-morbididades.
En conclusión
El uso de biomarcadores en diabetes, debido a la elevada prevalencia de esta enfermedad, debe ser poco invasivo, económicamente rentable y con la menor complejidad técnica posible para que sea efectivo el diagnóstico y el pronóstico no solo cuando aparecen los síntomas sino en programas de cribado generales de la población. Las evidencias obtenidas hasta el momento indican que las VEs son una fuente importante de biomarcadores para el diagnóstico y la predicción del riesgo y de la progresión de esta enfermedad. En los próximos años habrá que ir perfeccionando los aspectos técnicos para su aplicación en la práctica clínica.
Bibliografía
- Soriguer F, Goday A, Bosch-Comas A, Bordiu E, Calle-Pascual A, Carmena R, et al. Prevalence of diabetes mellitus and impaired glucose regulation in Spain: the Di@bet.es Study. Diabetologia. 2012;55(1):88-93.
- Rodriguez-Comas J, Moreno-Asso A, Moreno-Vedia J, Martin M, Castano C, Marza-Florensa A, et al. Stress-Induced MicroRNA-708 Impairs beta-Cell Function and Growth. Diabetes. 2017;66(12):3029-40.
- Mori MA, Ludwig RG, Garcia-Martin R, Brandão BB, Kahn CR. Extracellular miRNAs: From Biomarkers to Mediators of Physiology and Disease. Cell Metab. 2019;30(4):656-73.
- Ortega FJ, Mercader JM, Moreno-Navarrete JM, Rovira O, Guerra E, Esteve E, et al. Profiling of circulating microRNAs reveals common microRNAs linked to type 2 diabetes that change with insulin sensitization. Diabetes Care. 2014;37(5):1375-83.
- Parrizas M, Brugnara L, Esteban Y, Gonzalez-Franquesa A, Canivell S, Murillo S, et al. Circulating miR-192 and miR-193b Are Markers of Prediabetes and Are Modulated by an Exercise Intervention. The Journal of clinical endocrinology and metabolism. 2015;100(3):E407-15.
- Parrizas M, Mundet X, Castano C, Canivell S, Cos X, Brugnara L, et al. miR-10b and miR-223-3p in serum microvesicles signal progression from prediabetes to type 2 diabetes. Journal of endocrinological investigation. 2019.
- Prattichizzo F, De Nigris V, Sabbatinelli J, Giuliani A, Castaño C, Párrizas M, et al. CD31(+) Extracellular Vesicles From Patients With Type 2 Diabetes Shuttle a miRNA Signature Associated With Cardiovascular Complications. Diabetes. 2021;70(1):240-54.
- Lakhter AJ, Pratt RE, Moore RE, Doucette KK, Maier BF, DiMeglio LA, et al. Beta cell extracellular vesicle miR-21-5p cargo is increased in response to inflammatory cytokines and serves as a biomarker of type 1 diabetes. Diabetologia. 2018;61(5):1124-34.
- Garcia-Contreras M, Shah SH, Tamayo A, Robbins PD, Golberg RB, Mendez AJ, et al. Plasma-derived exosome characterization reveals a distinct microRNA signature in long duration Type 1 diabetes. Scientific reports. 2017;7(1):5998.
- Nunez Lopez YO, Iliuk A, Petrilli AM, Glass C, Casu A, Pratley RE. Proteomics and Phosphoproteomics of Circulating Extracellular Vesicles Provide New Insights into Diabetes Pathobiology. International journal of molecular sciences. 2022;23(10).