Obesidad
La obesidad, definida como una acumulación excesiva de grasa en varios órganos y partes del cuerpo, es una condición multifactorial, crónica y progresiva que conduce a consecuencias metabólicas y psicosociales adversas. Debido al rápido desarrollo y modernización global, que han conducido a importantes cambios en nuestro estilo de vida, como hábitos de alimentación no saludables, falta de ejercicio y estrés, en los últimos 50 años los índices de obesidad han experimentado un fuerte ascenso, alcanzando actualmente niveles alarmantes que la han convertido en una enfermedad de proporciones pandémicas. Según la Organización Mundial de la Salud, para el año 2030 se estima que un 19% de hombres y un 24% de mujeres desarrollarán obesidad, lo que supone más de mil millones de adultos en todo el mundo (World Obesity Atlas 2023. World Obesity Federation). Los porcentajes en niños y adolescentes no son menos alarmantes, con un 17% de niños y un 14% de niñas que desarrollarán obesidad. Estas cifras son incluso peores considerando que la obesidad supone un factor de riesgo muy importante para el desarrollo de otras enfermedades. Así, en 2019 la obesidad contribuyó a nivel mundial en aproximadamente 5 millones de muertes por enfermedad cardiovascular, diabetes tipo 2 (DT2), cáncer, enfermedades neurológicas, enfermedades respiratorias crónicas y digestivas1.
UNA VENTAJA DEL USO DE VECTORES VIRALES EN TERAPIA GÉNICA IN VIVO ES QUE EVITA LAS ADMINISTRACIONES PERIÓDICAS DE LA PROTEÍNA TERAPÉUTICA
Obesidad y diabetes tipo 2
Una de las enfermedades más fuertemente asociada con la obesidad es la DT2. Así, se estima que alrededor del 90% de los casos de esta enfermedad se atribuyen a un exceso de peso, y que la obesidad aumenta 4 veces el riesgo de desarrollar diabetes2. A nivel mundial, las predicciones apuntan a que para el año 2030, el número de casos diagnosticados de diabetes alcanzará los 643 millones (International Diabetes Federation). En España, un estudio llevado a cabo por el consorcio CIBERDEM (Centro de Investigación Biomédica en Red de Diabetes y Enfermedades Metabólicas Asociadas) estableció que el 30% de la población sufre de sobrepeso y tiene alguna alteración en el metabolismo de carbohidratos (proyecto Di@bet.es), y alrededor de 5 millones de personas sufren de DT2. Económicamente, la DT2 tiene un alto impacto en los sistemas nacionales de salud. Por ejemplo, en nuestro país, el tratamiento de esta enfermedad junto con sus complicaciones asociadas supuso un coste de 5.447 millones de euros en 2014. Sin embargo, el verdadero coste incluye también costes indirectos derivados de la enfermedad, que podrían aumentar esta cifra a 17.000 millones de euros. Considerando todos estos números, se hace indispensable encontrar tratamientos que permitan mitigar o curar esta enfermedad. Sin embargo, los tratamientos actuales para la DT2 son costosos para el sistema de salud y no han conseguido disminuir su creciente incidencia. Por lo tanto, es crucial avanzar en el conocimiento de los mecanismos moleculares que conectan la obesidad con la diabetes para encontrar nuevas aproximaciones y dianas terapéuticas para su tratamiento.
Alteraciones metabólicas inducidas por obesidad y su impacto en el desarrollo de diabetes tipo 2
La obesidad conlleva un aumento de la disponibilidad de energía por parte del organismo. Aunque en condiciones normales el exceso de energía se almacena en forma de grasa en el tejido adiposo, que es un órgano especializado en ello, en condiciones de obesidad, el gran exceso de energía sobrepasa la capacidad del tejido de almacenar grasa y ocasiona una serie de alteraciones morfológicas y moleculares que conducen a su disfunción. Por un lado, la grasa que no puede ser almacenada en el tejido adiposo se acumula en otros tejidos no diseñados para ello, como el músculo o el hígado. Esta condición se conoce como acumulación ectópica de grasa, que desencadena una serie de alteraciones que conllevan a la aparición de resistencia a la insulina, que es un factor clave en el desarrollo y la patogénesis de la DT2. Por otro lado, la obesidad induce hipertrofia e inflamación principalmente del tejido adiposo, con mayor presencia de macrófagos activados y otras células inmunológicas proinflamatorias. Esto conduce a una mayor secreción de citoquinas proinflamatorias que contribuyen a la resistencia a la insulina en tejidos periféricos y a la disfunción de la célula β pancreática3. En su conjunto, todas estas alteraciones conducen a una disminución de la captación de glucosa en músculo y tejido adiposo, y a un aumento en la producción hepática de glucosa favoreciendo niveles elevados de glucosa en sangre (hiperglucemia). Además, el aumento en la liberación de ácidos grasos por el tejido adiposo, que llegarán a otros tejidos, contribuirá aún más a generar resistencia a la insulina en los mismos. El páncreas, en un intento de vencer esta hiperglucemia secreta más insulina, llegándose a un estado de hiperinsulinemia. Esta situación perpetuada en el tiempo lleva a un agotamiento y disfunción de la célula β pancreática, que finalmente dejará de producir insulina, llegando al estado de diabetes establecida.
¿Qué es la terapia génica?
La terapia génica consiste en la trasferencia de material genético a células de un organismo (uno o varios tipos celulares) como herramienta terapéutica de una enfermedad. El objetivo es restablecer la función de un gen mutado o defectuoso, introducir una nueva función o interferir con una función ya existente. En el diseño de una terapia génica se deberán, por tanto, tener en cuenta tanto el material genético a transferir, como el método de transferencia y el tipo celular diana del tratamiento.
El objetivo final de las diferentes estrategias de terapia génica es la corrección del gen o la proteína deficiente mediante la administración de la propia proteína recombinante correcta o gracias a la producción de la proteína por las células que han recibido el gen correcto por terapia génica. La aplicación de la terapia génica tiene especial interés cuando no es necesario una restauración completa de la actividad normal de la proteína final o cuando no es necesario la modificación de todas las células del organismo.
Aunque inicialmente la terapia génica se centró en enfermedades hereditarias monogénicas, actualmente su aplicación se ha descrito también para diversas patologías como el cáncer, diabetes, obesidad o incluso enfermedades neurológicas. La Sociedad Española de Terapia Génica y Celular recoge los principales estudios clínicos activos que se están llevando a cabo en España en humanos (www.setgyc.es/ensayos-clínicos-en-españa).
En cuanto al método de transferencia, se han descrito diferentes estrategias de terapia génica como la introducción del material genético por métodos físicos como la electroporación o la terapia de reemplazo enzimática (enzyme replacement therapy) donde la proteína enzimática se administra periódicamente como una proteína recombinante. Sin embargo, el método más utilizado de terapia génica es mediante el uso de vectores virales genéticamente modificados para evitar su patogenicidad.
Terapia génica con vectores virales
La transferencia génica mediante vectores virales incluye el uso de adenovirus, retrovirus, lentivirus o virus adeno asociados (adeno-associated virus, AAVs), entre otros.
La administración del gen a través de vectores virales se puede llevar a cabo
- in vitro, donde la transferencia génica se realiza directamente en el cultivo celular del tejido a estudiar y donde se utilizan generalmente adenovirus,
- in vivo, donde la transformación celular tiene lugar dentro del individuo al que se le administra la terapia y donde se utilizan por ejemplo los AAVs, y
- ex vivo, donde la modificación celular se lleva a cabo a partir de una biopsia del tejido del individuo y posteriormente se le implantan las células ya transformadas. Un ejemplo de vectores virales utilizados ex vivo son los lentivirus (Figura 1).
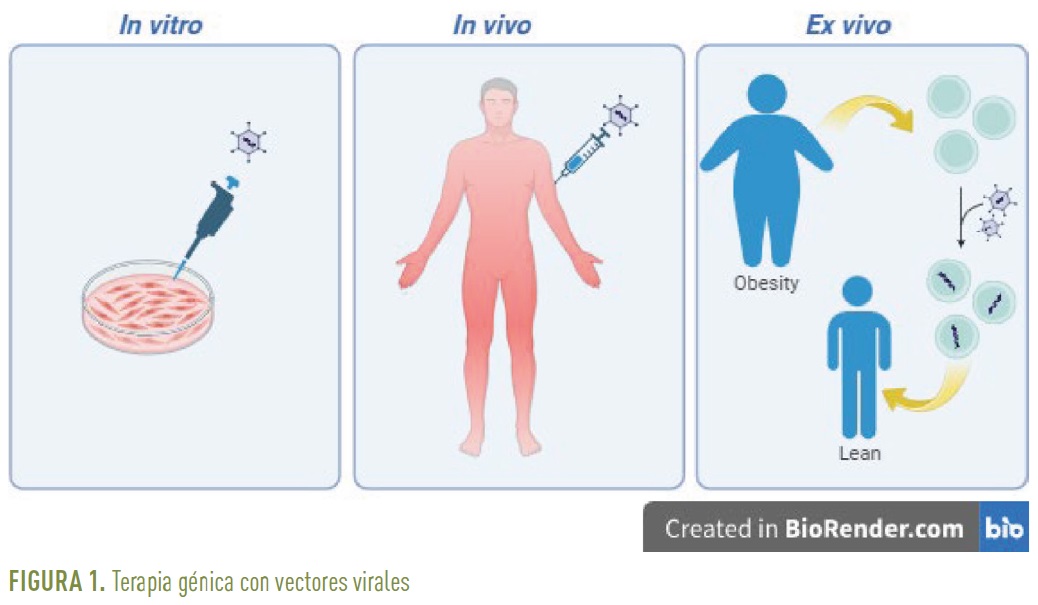
Una de las ventajas del uso de vectores virales en terapia génica in vivo es que evita las administraciones periódicas de la proteína terapéutica ya que son las propias células del organismo las que producen la proteína terapéutica. Los AAVs presentan ventajas interesantes para su uso in vivo tanto en ensayos preclínicos con modelos animales como en estudios clínicos en humanos ya que son no patogénicos, capaces de transducir tanto células en división como quiescentes, permiten una expresión a largo plazo del gen terapéutico, se pueden obtener grandes cantidades y a alta concentración y existen diferentes serotipos con diferentes tropismos para dirigir la expresión del gen a tejidos específicos. Como limitación se destaca que tienen una baja capacidad de clonaje aceptando material genético de como máximo 4,7 kilobases. Los AAVs se pueden administrar sistémicamente (vía intravenosa), de manera local con inyecciones en el propio tejido o incluso en el sistema nervioso central (vía una inyección intraparenquimal o vía el fluido cerebrospinal). Los AAVs han sido utilizados en ensayos clínicos desde mediados de los años 90 sin reportarse efectos adversos4. Más de 3.000 pacientes han participado en estos estudios con diferentes dosis y diferentes vías de administración dirigidas a hígado, músculo esquelético, cerebro y ojo. Por tanto, la terapia génica con AAVs es una estrategia robusta para el tratamiento de diferentes patologías.
Terapia génica en diabetes tipo 2 y obesidad
La obesidad y sus enfermedades metabólicas asociadas como la DT2 son multifactoriales. Esto hace que su estudio y potenciales terapias sean un reto tanto para la investigación como para la medicina y la salud. A pesar de ello se han descrito diferentes estudios preclínicos prometedores que se destacan a continuación.
Mediante el uso de AAVs para expresar el gen Fgf21 (Fibroblast Growth Factor 21) en hígado, tejido adiposo o músculo esquelético se ha conseguido que modelos de ratones con obesidad inducida tanto genéticamente como por dieta sean capaces de reducir el peso, la inflamación y el hígado graso5. También se produjo una mejora en la resistencia a la insulina que desencadena el desarrollo de la DT2 y el envejecimiento saludable. Mediante la terapia génica el animal era capaz de producir de manera continua la hormona FGF21 que regula el funcionamiento correcto a nivel energético en diversos tejidos.
Con una única inyección de AAVs que expresaba una forma permanentemente activa del gen Cpt1a (Carnitine Palmitoyltransferase 1A) en hígado de modelos animales de obesidad también se ha conseguido reducir el peso, la inflamación, la esteatosis hepática, la resistencia a la insulina y la diabetes6,7. La proteína enzimática CPT1A regula la oxidación de lípidos permitiendo eliminar el exceso de grasas presentes en la obesidad. Con esta misma proteína recientemente se ha demostrado su aplicación ex vivo con lentivirus8. En este caso se implantaron subcutáneamente en animales con obesidad células madre derivadas de tejido adiposo y modificadas para expresar la forma activa de CPT1A de manera que se consiguió reducir el peso, la diabetes, esteatosis hepática y los niveles de colesterol. Este estudio permite postular por una medicina personalizada y un trasplante autólogo donde tras una biopsia del paciente se puedan modificar las células aisladas mediante terapia génica e implantarlas de nuevo en el propio paciente.
ASÍ, SE ESTIMA QUE ALREDEDOR DEL 90% DE LOS CASOS DE ESTA ENFERMEDAD SE ATRIBUYEN A UN EXCESO DE PESO, Y QUE LA OBESIDAD AUMENTA 4 VECES EL RIESGO DE DESARROLLAR DIABETES
Otros estudios han utilizado también AAVs para expresar diferentes genes mediante terapia génica consiguiendo una mejora en la resistencia a la insulina y la obesidad en roedores, como por ejemplo los trabajos de Casana y Davidsohn9,10.
Tras estos ejemplos de resultados esperanzadores en ensayos preclínicos, los siguientes pasos serían probar y optimizar estas terapias en animales de mayor tamaño (ej. primates) para, después, comenzar con los ensayos clínicos en pacientes.
Limitaciones de la terapia génica con vectores virales
Estudios preclínicos tanto en roedores como en primates han probado la eficacia y seguridad de la terapia génica con vectores virales como los AAVs. Sin embargo, hay diferencias considerables entre las diferentes vías de administración en cuanto a los riesgos asociados al procedimiento, las dosis requeridas del vector viral, la sensibilidad al efecto de los anticuerpos neutralizantes presentes en la sangre que puedan bloquear la transducción de los AAVs y la potencial toxicidad.
Conclusiones y perspectivas futuras
La corrección del defecto genético en todas las células de un órgano normalmente no es necesaria ya que la corrección de un limitado número de células puede producir suficiente cantidad de proteína activa disponible para células vecinas, otras células presentes en el tejido o incluso otros órganos si la proteína alcanza fluidos como la sangre. Esta es una clara ventaja del uso de la terapia génica donde no se modifican todas las células de un organismo.
Estudios en modelos animales han proporcionado evidencias que apoyan la eficacia y seguridad de la terapia génica para la terapia de la obesidad y la diabetes tipo 2. Esto garantiza en gran medida la proyección de su eficacia en humanos. Se ha de tener en cuenta que las comparaciones entre los estudios preclínicos y clínicos no son tan directas y se deberán primero optimizar diferentes aspectos como los criterios de inclusión, diseño de protocolos, o la fabricación a escala de los vectores. Por tanto, los futuros estudios clínicos dirigidos a una terapia génica en obesidad y diabetes tipo 2 deberían enfocarse en qué estrategia de transferencia génica conlleva el mayor beneficio clínico y el menor riesgo.
Bibliografía
- Chong, B. et al. Trends and predictions of malnutrition and obesity in 204 countries and territories: an analysis of the Global Burden of Disease Study 2019. EClinicalMedicine 57, (2023).
- Field, A. E. et al. Impact of Overweight on the Risk of Developing Common Chronic Diseases During a 10-Year Period.
- Shoelson, S. E., Herrero, L. & Naaz, A. Obesity, Inflammation, and Insulin Resistance. Gastroenterology 132, 2169–2180 (2007).
- Mendell, J. R. et al. Current Clinical Applications of In Vivo Gene Therapy with AAVs. Molecular Therapy vol. 29 464–488 Preprint at https://doi.org/10.1016/j.ymthe.2020.12.007 (2021).
- Jimenez, V. et al. FGF21 gene therapy as treatment for obesity and insulin resistance. EMBO Mol Med 10, (2018).
- Orellana-Gavaldà, J. M. et al. Molecular therapy for obesity and diabetes based on a long-term increase in hepatic fatty-acid oxidation. Hepatology 53, 821–832 (2011).
- Weber, M. et al. Liver CPT1A gene therapy reduces diet‐induced hepatic steatosis in mice and highlights potential lipid biomarkers for human NAFLD. The FASEB Journal 34, 11816–11837 (2020).
- Soler-Vázquez, M. C. et al. Implantation of CPT1AM-expressing adipocytes reduces obesity and glucose intolerance in mice. Metab Eng 77, 256–272 (2023).
- Casana, E. et al. AAV-mediated BMP7 gene therapy counteracts insulin resistance and obesity. Mol Ther Methods Clin Dev 25, 190–204 (2022).
- Davidsohn, N. et al. A single combination gene therapy treats multiple age-related diseases. Proc Natl Acad Sci U S A 116, 23505–23511 (2019).







