El pasado 19 de septiembre tuvo lugar la 58 edición del congreso europeo de mayor relevancia en el ámbito básico y clínico en diabetes, la reunión anual de la European Association for the Study of Diabetes (EASD).
Un evento de especial relevancia en su presente edición, ya que, tras 2 años en modalidad virtual debido a la coyuntura sanitaria, este año ha recuperado la presencialidad en Estocolmo (Suecia). Por primera vez, se ha llevado a cabo con gran éxito un formato hibrido presencial-virtual, que ha permitido una mayor difusión de los contenidos y novedades presentados. Este nuevo formato ha permitido la participación de más de 11.300 delegados, de los cuales más de 7.800 atendieron el evento de forma presencial.
Con un total de 878 comunicaciones aceptadas y presentadas, tratar de realizar un resumen de lo más destacado es una ardua tarea que siempre estará influenciada por el interés y perfil del analista. Sin perder de vista lo anterior, en este artículo se trata de reseñar los trabajos más destacados y novedosos en el ámbito de la investigación básica y aplicada en diabetes.
¿Cómo se regula la formación y liberación de insulina en las células beta pancreáticas?
Conocer los mecanismos de síntesis y liberación de la insulina en las células beta pancreáticas ha sido siempre una de las líneas de investigación básica clave seguida por multitud de grupos de investigación en todo el mundo. Aportar luz en este sentido puede llevar a la identificación de nuevas dianas farmacológicas que mejoren la síntesis y liberación de la insulina por las propias células del paciente. A este respecto, investigadores de la Universidad de Uppsala (Suecia) han presentado datos muy relevantes sobre la regulación de la liberación de insulina en las células beta pancreáticas, mostrando cómo existe una clara anomalía en el transporte y liberación de la insulina en pacientes con diabetes tipo 2. Investigadores de esta misma universidad y otros grupos de universidades como la de Sidney (Australia) han identificado nuevas proteínas, como la liprina y la villina, importantes en la regulación de la liberación de la insulina y por tanto, posibles dianas terapéuticas a tener en cuenta.
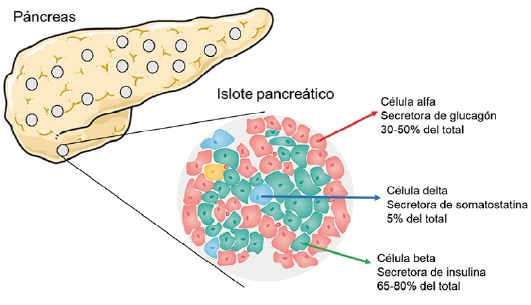

No todo es insulina: Otras hormonas del islote pancreático contribuyen a la regulación la glucemia
Los islotes pancreáticos son estructuras multicelulares que se encuentran diseminadas por todo el páncreas y que se caracterizan por la liberación de hormonas características. Las distintas hormonas liberadas por estas células regulan los niveles de glucosa en sangre y viceversa. Los tres tipos de células más abundantes son las células beta, alfa y delta, responsables de la liberación de insulina, glucagón y somatostatina, respectivamente.
El estudio de la regulación de las células beta ha sido tradicionalmente el más abordado en investigación básica en diabetes, ya que se trata del tipo celular encargado de liberar la insulina, hormona principalmente afectada en esta enfermedad. Pero es importante no perder de vista al resto de componentes, ya que cada vez hay más evidencias de su activa participación en el desarrollo de esta patología.
Es bien conocido que estas hormonas tienen un papel importante en el mantenimiento y regulación de los niveles de glucosa en sangre, así como en la liberación de la propia insulina. Por un lado, las células alfa liberan glucagón en respuesta a la hipoglucemia, que producirá la liberación de glucosa almacenada en el hígado al torrente sanguíneo, restaurando los niveles de glucosa circulantes. Por otro lado, se sabe que las células delta, liberan somatostatina en respuesta a la hiperglucemia y que esta hormona tiene la capacidad de reprimir la liberación de insulina y glucagón en las células vecinas del islote pancreático.
El Dr. Zhang de la Universidad de Oxford (Inglaterra), lidera toda una línea de investigación a este respecto, desvelando los mecanismos moleculares que regulan la secreción de somatostatina y su influencia y relación con las secreciones de insulina y glucagón. Estudios previos han constatado que la ausencia de células delta en el páncreas endocrino lleva a cuadros de hipoglucemia y que pacientes con tumores neuroendocrinos derivados de este tipo celular (somatostatinomas) cursan en la mayoría de los casos con diabetes asociada.
Está bien establecido que las células delta responden a los niveles de glucosa de forma similar a las células beta, es decir, a mayor concentración de glucosa, mayor secreción de la hormona. Teniendo esto en cuenta, Zhang y colaboradores tratan de responder a las siguientes preguntas:
¿Trabajan las células delta de forma similar a las células beta?
¿Cuál es el sentido fisiológico de la presencia de células delta, secretoras de somatostatina, en la regulación del islote pancreático?
¿Cuál es la influencia de la secreción hormonal de estas células en la regulación de los niveles de glucosa en sangre?
Aplicando protocolos de electrofisiología en islotes completos, han llegado a la conclusión de que las células delta funcionan de forma similar a las células beta y además están acopladas de forma directa, lo que favorece una fina regulación mutua. Además, han comprobado que también existe un mecanismo de regulación y comunicación con las células alfa secretoras de glucagón. La presencia de células delta, secretoras de somatostatina en el islote pancreático, y su comunicación con las células vecinas respondería a un mecanismo de “control de seguridad” de liberación excesiva de insulina y glucagón por parte del páncreas.
Dando un paso más allá, Lina Matuseviciene, investigadora de la Universidad de Uppsala (Suecia), ha presentado datos muy relevantes estudiando la función delta pancreática en islotes procedentes de donantes con diabetes tipo 2. Estos pacientes tienen una liberación de somatostatina disminuida en respuesta a glucosa, dando como resultado final una liberación insuficiente de la hormona. Además, las células beta y alfa vecinas son resistentes a la acción de la somatostatina liberada. Dicha resistencia se debe a la internalización de los receptores de somatostatina, que deberían encontrarse en la superficie de las células en condiciones normales, pero que en el caso de los pacientes con diabetes se encuentran en el interior celular, impidiendo la señalización hormonal. En definitiva, la secreción de somatostatina en islotes pancreáticos de pacientes con diabetes está reducida y además existe un mecanismo de resistencia a la hormona en las células adyacentes que acentúa la pérdida de señalización.
Teniendo en cuenta ambos estudios, los pacientes con diabetes tendrían el “control de seguridad” que ejerce la somatostatina sobre la liberación de insulina y glucagón alterado. Este “freno” fisiológico al exceso de liberación de insulina y glucagón desaparece, contribuyendo de forma relevante la descompensación de las glucemias y a la patología diabética.
Reemplazo de células beta pancreáticas: En el camino hacia la cura de la diabetes tipo 1.
El reemplazo de las células beta-pancreáticas secretoras de insulina, que se pierden durante la evolución de la diabetes y que es especialmente dramática en el caso de personas con diabetes tipo 1, es uno de los campos de investigación básica en el que se están poniendo más esfuerzos y recursos por tratarse de una de las vías más tangibles para conseguir la cura de la enfermedad.
Para llevar a cabo el reemplazo de células productoras de insulina en pacientes con diabetes hay dos importantes estrategias en desarrollo: el trasplante de islotes pancreáticos procedentes de donantes, y el desarrollo de islotes pancreáticos derivados de células madre, que también podrían ser trasplantados.
EN DEFINITIVA, LA SECRECIÓN DE SOMATOSTATINA EN ISLOTES PANCREÁTICOS DE PACIENTES CON DIABETES ESTÁ REDUCIDA Y ADEMÁS EXISTE UN MECANISMO DE RESISTENCIA A LA HORMONA EN LAS CÉLULAS ADYACENTES QUE ACENTÚA LA PÉRDIDA DE SEÑALIZACIÓN
Uno de los principales retos a superar para que el trasplante tenga éxito es evitar la muerte de los islotes trasplantados. En condiciones normales los islotes pancreáticos están en un entorno muy vascularizado que asegura el correcto intercambio de nutrientes. La revascularización en islotes trasplantados se genera de forma lenta, lo que lleva en la mayoría de los casos a la muerte de los mismos por hipoxia. Mejorar el intercambio de nutrientes y la oxigenación es una de las claves que está tratando de resolver el grupo liderado por el Dr. Duffy de la Universidad de Galway (Irlanda). Estos investigadores han desarrollado un biomaterial, denominado oxygel. El oxygel es un hidrogel oxigenado que podría ser utilizado para mejorar la eficacia del trasplante de islotes.
Por una parte, tiene la consistencia adecuada para recubrir los islotes y darles soporte, y por otra proporciona un ambiente oxigenado que evita la hipoxia. Por el momento han comprobado que la viabilidad de los islotes en esta matriz oxigenada es muy buena y están comenzando a realizar ensayos funcionales para comprobar que la función de los islotes trasplantados no se ve alterada por el biomaterial.

La generación de islotes procedentes de células madre para su posterior trasplante quizá sea una de las estrategias más alentadoras en el alcance de la cura de la diabetes tipo 1. En esta línea, el Dr. Tom Barsky de la Universidad de Helsinky (Finlandia) presentó las novedades de su trabajo. Este grupo de investigadores ha conseguido desarrollar un complejo protocolo en el que consiguen generar islotes pancreáticos a partir de células madre en 6 semanas. Se trata de un increíble hito si tenemos en cuenta que los islotes son estructuras multicelulares que secretan diversas hormonas en respuesta a diferentes estímulos de glucosa y otros nutrientes. Los islotes conseguidos hasta el momento tienen una buena funcionalidad en cuanto a respuesta a glucosa y liberación hormonal pero no reproducen de forma fiel el metabolismo mitocondrial de las células. El Dr. Barsky y sus colaboradores están redoblando esfuerzos para conseguir mejorar su protocolo y llegar a la generación de islotes maduros perfectamente funcionales candidatos a ser trasplantados.
Por último, destacar el galardón Rising Star otorgado al Dr. Diego Balboa, premio que reconoce la actividad destacada y proyección de jóvenes investigadores en diabetes. El Dr. Balboa, investigador postdoctoral en el grupo de Jorge Ferrer en el Centro de Regulación Genómica (CRG) en Barcelona y miembro del grupo de trabajo de investigación básica de la SED, es el primer autor del protocolo de generación de islotes a partir de células madre, publicado recientemente en la revista Nature Biotechnology. Su experiencia en este ámbito le ha llevado a interesarse por conocer cómo se produce el control genético que da identidad a las células beta, así como intentar identificar nuevas mutaciones que conducen a la diabetes. Investigaciones que pueden llevar a la mejora en la maduración y funcionalidad de los islotes generados a partir de células madre.
Además, como novedad dentro de las actividades organizadas por la asociación, este año se ha lanzado la EASD Academy. Se trata de una iniciativa para apoyar, formar, orientar y crear oportunidades para científicos, clínicos y estudiantes que se encuentren en una fase temprana o intermedia de su carrera, con interés en la investigación y/o la práctica clínica de la diabetes. A través de la organización de múltiples actividades y programas, apoyará y motivará a los investigadores básicos y clínicos que inician su carrera en el campo de la diabetes.
Sin duda, estas son algunas de las aportaciones más destacadas del congreso europeo celebrado este año en Estocolmo (Suecia). Esperamos poder seguir la evolución de todos estos relevantes y esperanzadores estudios en la próxima edición de que se celebrará del 2 al 6 de octubre de 2023 en Hamburgo, Alemania.







