A pesar de los actuales avances científicos, la diabetes 2 carece de criterios diagnósticos concretos más allá de los comunes a cualquier forma de diabetes. De hecho, es muy heterogénea en cuanto a su presentación clínica, evolución y respuesta al tratamiento. Un objetivo de la medicina personalizada de precisión en diabetes en línea con el recientemente publicado “Documento ADA / EASD de consenso sobre la medicina de precisión para la diabetes, 2020” es poder desarrollar nuevas clasificaciones que nos ayuden a simplificar los tratamientos consiguiendo la combinación más eficaz con los menores efectos secundarios. Específicamente, la estratificación de las personas con diabetes tipo 2 en subgrupos con similares evoluciones y respuestas farmacológicas podría ayudar a seleccionar el mejor tratamiento para cada subgrupo. En este articulo pretendemos resumir la evidencia científica disponible que nos ayuda a mejorar la subclasificación de las diabetes 2, con especial atención al valor que aporta la genética, tras los importantes avances que se han producido recientemente en esta área de conocimiento.
INTRODUCCION
Los últimos datos reportados por la Federación Internacional de Diabetes (IDF) confirman a la diabetes como una de las emergencias sanitarias del siglo XXI. Casi 500 millones de personas en distintas partes del mundo viven hoy con diabetes y se estima que esta cifra aumente a 700 millones en el año 2045. El fracaso de las actuales estrategias de prevención podría ser un factor fundamental para esta preocupante evolución que generará una importante carga personal, social y económica, secundarias, sobre todo, a las complicaciones asociadas al mal control metabólico. Es urgente tanto su prevención como el diagnóstico precoz, así como el tratamiento adecuado de las personas con diabetes.
El concepto de medicina personalizada de precisión se utiliza desde el 2011 para describir tratamientos médicos diseñados para las características especiales de cada paciente, utilizando como herramienta la medicina de precisión. La medicina de precisión constituye una herramienta esencial para la aplicación de criterios de segmentación de la población, posibilitando adaptar estrategias preventivas, diagnósticas y terapéuticas a las características de los pacientes. En este modelo de cuidados, la tradicional historia clínica, examen físico y pruebas de laboratorio son potenciados por las denominadas “ómicas “(genómica, epigenómica, transcriptómica, proteómica, metabolómica y metagenómica/microbioma) que permiten identificar características únicas de la persona con diabetes y guiar la toma de decisiones clínicas.
Un objetivo de la medicina de precisión en diabetes en línea con el recientemente publicado “Documento ADA / EASD de consenso sobre la medicina de precisión para la diabetes” es poder desarrollar nuevas clasificaciones que nos ayuden a simplificar los tratamientos y conseguir la mejor combinación de eficacia con los menores efectos secundarios.
HETEROGENEIDAD DE LA DIABETES.
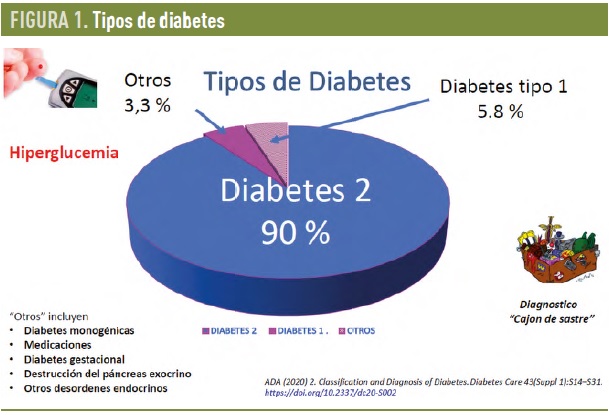
Clasificación actual de la diabetes. La diabetes es diagnosticada por el aumento de un único metabolito, la glucosa, y puede deberse a múltiples procesos etiológicos que varían entre individuos. Estos procesos influencian sobre sus características clínicas, la progresión, la respuesta a fármacos y el desarrollo de complicaciones. La diabetes es dividida clásicamente en varios tipos (Fig. 1). La diabetes tipo 1 resulta de la destrucción autoinmune de la célula beta que se refleja, aunque no siempre, por la presencia de autoanticuerpos pancreáticos en la sangre que pueden ser utilizados como marcadores diagnósticos. Su presencia es un potente indicador de que el paciente necesitará insulina para mantener sus glucemias en rangos normales. Por otro lado, las diabetes monogénicas causadas por la alteración de un único gen (MODY y diabetes neonatales) aparecen en el 3 % de las diabetes diagnosticadas antes de los 30 años de edad. Su diagnóstico requiere estudiar hasta unos 15 genes (MODY) y 26 genes (diabetes neonatales) conocidos hasta ahora implicados en estos tipos de diabetes para detectar en ellos mutaciones con implicaciones directas en la elección de tratamiento.
Tras la exclusión de estos y otros subtipos de diabetes secundarias (uso de corticoides, fibrosis quística, hemocromatosis etc.), el restante, 85-90% son considerados diabetes tipo 2 (DM2). Es más, como los autoanticuerpos pancreáticos no siempre son evaluados y los diagnósticos genéticos no siempre están disponibles, el grupo de DM2 en demasiadas ocasiones incluye pacientes con diabetes autoinmunes y monogénicas no diagnosticadas.
Evidencias de que la diabetes 2 incluye múltiples enfermedades. El estereotipo de una persona con DM2 es de alguien con sobrepeso u obesidad con signos de resistencia a la insulina; sin embargo, no todos las DM2 entran en este molde pues hay una elevada heterogeneidad en cuanto a características clínicas, progresión y riesgo de complicaciones. El reconocimiento de esta heterogeneidad ha impulsado varios esfuerzos para redefinir la clasificación de la DM2.
Modelos propuestos de heterogeneidad dentro de la diabetes 2. La identificación en estudios de distintas poblaciones de subtipos de DM2 con diferentes perfiles de riesgo y procesos fisiopatológicos subyacentes abre las vías para una medicina personalizada y permite centrar recursos en las personas con DM2 que tienen más probabilidad de desarrollar complicaciones, mejorando así tanto la salud de las mismas como los costes asociados. Además, tener identificadas poblaciones homogéneas de pacientes ofrece la posibilidad de ayudar a los estudios experimentales, genéticos y clínicos.
Por una parte, los DATOS CLÍNICOS, fácilmente disponibles, pueden reflejar vías relevantes de la enfermedad, integrando los efectos tanto genéticos como de exposiciones ambientales. La clasificación más relevante en este momento (Ahlqvist E et al, 2018), utiliza seis parámetros clínicos recogidos al diagnóstico:
- autoanticuerpos pancreáticos -GAD-
- edad al inicio de la diabetes
- hemoglobina glicosilada
- Índice de Masa Corporal
- medidas de resistencia
- y de secreción de insulina
Para agrupar a las personas con diabetes de inicio en la edad adulta en cinco subtipos (subclasificación ANDIS):
- diabetes autoinmune severa
- diabetes con déficit severo de insulina
- diabetes por resistencia severa a la insulina
- diabetes leve relacionada con la obesidad
- diabetes leve relacionada con la edad.
Cada subtipo se asocia a diferentes características y riesgos de complicaciones. Así el grupo con “diabetes grave por deficiencia de insulina” tiene aumentado el riesgo de retinopatía y neuropatía, mientras que el grupo de “diabetes severa resistente a la insulina” tiene un mayor riesgo de enfermedad renal diabética e hígado graso. Esta última vinculación enfatiza la importancia de la resistencia a la insulina para la enfermedad renal y para el acúmulo de grasa en el hígado en la DM2. Estos subtipos y su evolución se han reproducido de forma robusta en varias poblaciones (Alemania, China, USA, México e India) y sobre datos de ensayos clínicos previos como el ADOPT y el RECORD. De esta forma, la clasificación desde el diagnóstico por 6 características clínicas (fenotipos) en 5 subgrupos, con diferencias en la progresión de la enfermedad apareció como una promesa a la hora de poder individualizar los tratamientos. Sobre la base de esta subclasificación basada en criterios clínicos ¿qué puede entonces aportar la genética?
¿POR QUÉ CONSIDERAR LA GENÉTICA PARA SUBTIPIFICAR LA DIABETES 2?
La DM2 es una enfermedad poligénica, esto es, implica la interacción de muchas variantes genéticas, de las que hasta la fecha se han descubierto más de 200; tiene una heredabilidad estimada del 30-70%, cifra que captura tanto el riesgo genético como la exposición ambiental familiar compartida, tanto prenatal como postnatal.
Estudios a gran escala, el acceso a grandes cohortes de datos en los biobancos, una tecnología emergente para el estudio del genoma y avanzadas herramientas bioinformáticas nos están ayudando a conocer la arquitectura genética de la DM2. Sin embargo, una cuestión crítica es considerar si la genética es relevante para la subclasificación de la DM2. Contamos con varias razones para considerar que sí:
1. Uno de los avales de la utilidad de la genética en la subclasificación de DM2 viene dado por la existencia de las diabetes monogénicas. Se estima que alrededor del 80% de las diabetes monogénicas están sin diagnosticar y en estos casos el empleo de la genética para su detección ya reduce la heterogeneidad de la DM2 atribuible al diagnóstico erróneo de este tipo de diabetes.
2. Dentro de los subgrupos clínicos ya definidos puede existir una heterogeneidad genética clínicamente importante. Ocurre incluso con las anteriormente mencionadas diabetes monogénicas. En ellas la afectación de diferentes genes, genera manifestaciones clínicas completamente singulares. Ello ocurre igualmente en cada uno los subtipos descritos de DM2, aunque tengamos peores herramientas para detectarlo. De hecho, mientras no tengamos otros biomarcadores relevantes, la genética prácticamente es la única forma rigurosa de aproximación diagnóstica.
3. La genética puede además guiar el manejo de la enfermedad. En el caso de la clasificación “clínica” la relación mecanística no es clara, mientras que los marcadores genéticos están en la raíz del problema. Aunque las alteraciones genéticas asociadas a la DM2 globalmente tienen un modesto efecto, no superior a un 20% más de riesgo que la población general, es posible que en algunos individuos la integración de este riesgo asociado a varios genes (scores de riesgo poligénico) impacte una o más vías de desarrollo de la DM2 profundamente y de esta forma, estas vías podrían ser útiles como dianas terapéuticas.
4. Finalmente, en contraste con los datos clínicos o de laboratorio, los marcadores genéticos no cambian a lo largo de la vida y no se afectan por los tratamientos o la evolución de la DM2. Es decir, pueden ser útiles en cualquier momento de la vida y para siempre, incluso antes de que la diabetes se inicie de tal forma que se pueden incluso activar estrategias preventivas.
ESFUERZOS POR UTILIZAR LA GENÉTICA PARA FILIAR LOS SUBTIPOS DE DM2
Durante la última década ha habido avances muy importantes en la identificación y caracterización de variantes genéticas asociadas con riesgo de DM1 y DM2. Estas variantes que nos informan de los mecanismos moleculares, celulares y fisiológicos implicados; cuando se combinan obtenemos los denominados scores de riesgo (puntuaciones de riesgo) que cuantifican la información de patrones individuales de predisposición y de evolución de enfermedad que pueden ser útiles para su manejo clínico. Sin embargo, estos scores de riesgo de DM2 informan sobre el riesgo global de DM2 y no de su heterogeneidad (subtipos de DM2). Una ruta atractiva para capturar los elementos de esta heterogeneidad clínica es a través de unos nuevos scores de riesgo, los asociados a los procesos biológicos implicados en la aparición de la DM2.
A pesar de los avances en el conocimiento de la mayoría de los genes relacionados con la DM2 desconocemos que variantes genéticas, elementos reguladores, genes o tejidos son funcionalmente más relevantes. Los recientes estudios independientes de Udler M. y cols, y Mahajan A. y cols puentean esta falta de información y conectan las variantes genéticas directamente con los procesos biológicos y sus vías metabólicas implicadas.
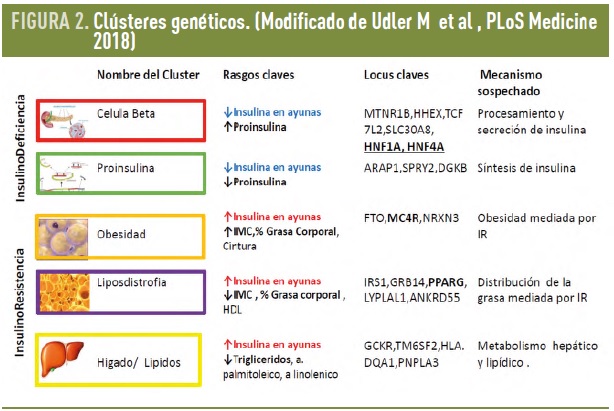
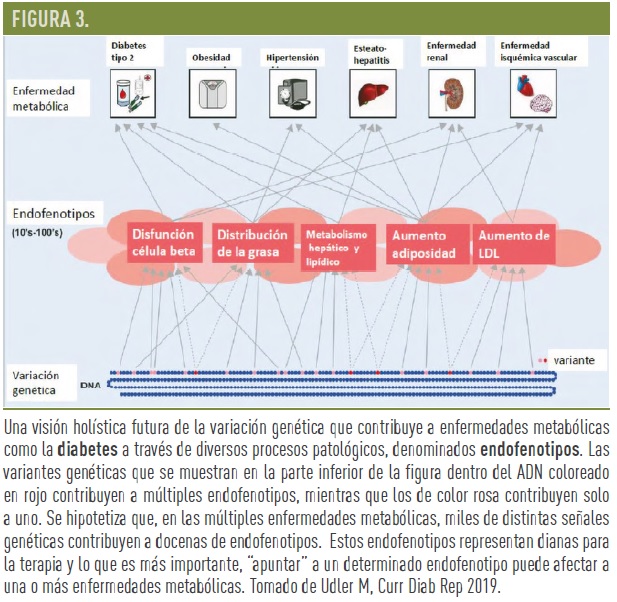
Udler M. et al, (2018) integrando la información genética disponible de los estudios de asociación del genoma completo (GWAS) con innovadoras técnicas estadísticas para agrupar sujetos que comparten rasgos clínicos y genéticos, analizaron los datos de 14.183 sujetos de muestras del biobanco de Inglaterra que habían sido utilizadas para los estudios GWAS. Las técnicas bioinformáticas utilizadas permiten explícitamente que una misma variante pueda estar implicada en más de un proceso metabólico. Tomando 94 variantes genéticas asociadas a DM2 y 47 de rasgos metabólicos asociados a DM2, identificaron 5 subgrupos de locus genéticos robustos de significancia biológica y que informaban de las vías mecanísticas: 2 subgrupos de locus genéticos (clústeres) se relacionan con la función beta pancreática, representando déficit síntesis y déficit de procesamiento de insulina; y los otros 3 subgrupos (clústeres) representan mecanismos de insulino resistencia: obesidad, lipodistrofia y alteración del metabolismo hepático (Fig 2). Estos clústeres fueron ampliamente coincidentes con los 6 aportados por Mahajan et al. en un trabajo paralelo e independiente sobre 450.000 individuos, utilizando también 94 variantes genéticas asociadas a DM2 y 10 asociadas a rasgos metabólicos de DM2. Cada uno de estos 5-6 subgrupos de locus genéticos representan mecanismos de enfermedad o “endofenotipos”, compartidos por la diabetes y por otros procesos metabólicos y que pueden ser utilizados como dianas terapéuticas. (Fig. 3).
Posteriormente, unificando datos de otros biobancos, se detectó que aproximadamente el 30% de la población general tiene una carga genética importante que los sitúa en niveles superiores de los scores de riesgo de alguno de estos subgrupos donde queda por demostrar si pertenecer a cada uno de ellos implica una respuesta diferente a los tratamientos empleados y si tienen diferente tasa de progresión de enfermedad y desarrollo de complicaciones.
LIMITACIONES DE LA GENÉTICA EN DM2.
Aunque la identificación de un número importante de nuevos marcadores genéticos (variantes genéticas) de susceptibilidad ha abierto la oportunidad de traducir esta información genética en la mejora de la predicción del riesgo de DM2, los datos disponibles sugieren que el cribado genético es actualmente de poco valor en la práctica clínica. La genética aún hoy aporta muy pocas ventajas al poder predictivo proporcionado solo por los datos clínicos (edad, índice de masa corporal -IMC- y glucemia). Asimismo, tenemos que reconocer que actualmente los marcadores genéticos son insuficientes para establecer una terapia específica excluyendo algunos casos de diabetes monogénicas. Por otro lado, no hay que olvidar que la mayor parte de los datos analizados en los estudios pertenecen a población occidental por lo que los resultados deben ser validados en otras poblaciones.
No podemos olvidar que la DM2 es una enfermedad multifactorial donde la predisposición genética es influenciada por factores no genéticos o ambientales. Hay una limitación a lo que la genética sola puede aportar, y será de utilidad conocer mejor las interacciones de los factores ambientales y conductuales con los genéticos. Técnicas avanzadas de bioinformática, como “machine learning”, están desempeñando un papel importante a la hora de dar respuesta a estos retos.
CONCLUSIONES
Las personas con diabetes pueden beneficiarse de subclasificaciones (clínicas o genéticas) que a su vez informan de la causa de la diabetes, su fisiopatología y su historia natural a fin de seleccionar las mejores estrategias de prevención y tratamiento.
Un puñado de subclasificaciones de diabetes en diversos subgrupos han aparecido en los últimos años utilizando datos fenotípicos (características de los pacientes y datos de laboratorio) asociados a distinta evolución y riesgo de complicaciones. Estas clasificaciones basadas en datos clínicos (fenotipo) dependen del momento de medida de la variable y no van al origen de la DM2. Los datos genéticos por el contrario son esencialmente inalterables a lo largo de la vida de la persona y están en la raíz de los mecanismos subyacentes.
El análisis de variantes genéticas asociadas a la DM2 y a los procesos metabólicos implicados ha permitido identificar al menos 5 subgrupos de locus genéticos que representan mecanismos de enfermedad o “endofenotipos”, compartidos por la diabetes y por otros procesos metabólicos y que pueden ser dianas terapéuticas, aunque hace falta más investigación para determinar su utilidad clínica real.
Como retos importantes quedan:
1. Aplicar estos hallazgos a distintas poblaciones pues gran parte de los estudios se han llevado a cabo en población occidental.
2. Abordar nuevas aproximaciones que combinen características clínicas y genéticas en un modelo único, también incorporando factores ambientales tales como dieta, estilo de vida, contaminación y otras variables psicosociales.
Ambos retos ya tienen a importantes investigadores trabajando en ellos, entre los que destaca el equipo liderado por el español José Carlos Flórez en el Centro de Medicina Genómica Broad Institute, Boston (Massachusetts), donde desarrollan su actividad investigadora en estas líneas entre otros Miriam Udler y el catalán Txema Mercader. Estamos en buenas manos.
BIBLIOGRAFIA
- American Diabetes Association. Precision medicine in diabetes initiative. Available at: https://professional.diabetes.org/ content-page/precision-medicine. Accessed May 7, 2019
- American Diabetes Association: Classification and diagnosis of diabetes: standards of medical care in diabetes-2019. Diabetes Care. 2020;43(Suppl 1):S14–31.
- Ahlqvist E, Storm P, Käräjämäki A, Martinell M, Dorkhan M,Carlsson A, et al. Novel subgroups of adult-onset diabetes and their association with outcomes: a data-driven cluster analysis of six variables. Lancet Diabetes Endocrinol. 2018;6:361–9
- Hattersley AT, Greeley SAW, Polak M, Rubio-Cabezas O, NjølstadPR, Mlynarski W, et al. ISPAD Clinical Practice Consensus Guidelines 2018: the diagnosis and management of monogenic diabetes in children and adolescents. Pediatric Diabetes 2018;19(Suppl 27):47–63. Esta guía resume la correlación de genotipo y fenotipo en diabetes monogénicas.
- Mahajan A, Taliun D, Thurner M, Robertson NR, Torres JM, Rayner NW, et al. Fine-mapping type 2 diabetes loci to single variant resolution using high-density imputation and islet-specific epigenome maps. Nat Genet. 2018;50(11):1505–13.
- Mahajan A, Wessel J, Willems SM, Zhao W, Robertson NR, ChuAY, et al. Refining the accuracy of validated target identification through coding variant fine-mapping in type 2 diabetes. Nat Genet.2018;50(4):559–71.
- Cigudosa J y cols. MEDICINA PERSONALIZADA DE PRECISIÓN EN ESPAÑA: MAPA DE COMUNIDADES. Fundación Instituto Roche 2019.
- Udler M Current Diabetes Reports (2019) 19: 55Type 2 Diabetes: Multiple Genes, Multiple Diseases.
- Udler MS, et al. Type 2 diabetes genetic loci informed by multi-trait associations point to disease mechanisms and subtypes: a soft clustering analysis. PLoS Med. 2018;15(9):e1002654.
- Chung WK, Erion K, Florez JC, Hattersley AT, Hivert MF, Lee CH, et al. Medicine in Diabetes: A Consensus Report from the American Diabetes Association (ADA) and the European Association for the Study of Diabetes (EASD). Diabetes Care 2020;43:1617–1635