La enfermedad conocida como diabetes mellitus es un trastorno metabólico complejo, caracterizado por la presencia crónica de niveles altos de glucosa en sangre (hiperglucemia) como consecuencia de una secreción o acción defectuosa de la insulina.
El origen de la enfermedad es muy diverso, y los factores de riesgo, tanto los genéticos como los ambientales que intervienen en su desarrollo son muy diferentes para cada tipo de diabetes.
Desde el punto de vista genético se pueden diferenciar las diabetes poligénicas de las monogénicas. En las diabetes poligénicas, muchos genes dan riesgo o predisponen a padecer la enfermedad, mientras que otros protegen. Sin embargo, en las diabetes monogénicas, la alteración de un solo gen es la causa de la enfermedad. Clínicamente es difícil distinguirlas ya que los síntomas/signos de los diferentes tipos de diabetes se superponen.
¿Cuáles son las diabetes poligénicas?
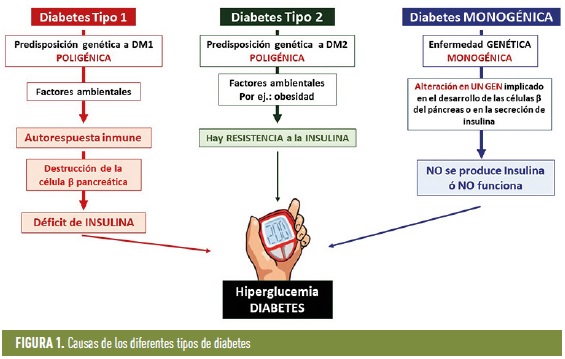
Entre las diabetes poligénicas se encuentran la diabetes tipo 1 (DM1), la más frecuente en la infancia y la adolescencia, y la diabetes tipo 2 (DM2), más frecuente en la edad adulta. Ambas son enfermedades complejas en las que la genética predispone a la diabetes, y la aparición de la enfermedad requiere de la interacción con factores ambientales en personas con riesgo genético (figura 1).
La diabetes tipo 1 es una enfermedad de origen autoinmune en la que el propio cuerpo ataca por error y destruye sus células β del páncreas (aquellas que producen insulina), lo que conduce a la necesidad de un tratamiento con insulina durante toda la vida. Reflejo de este ataque autoinmune, es la presencia de autoanticuerpos en la sangre del paciente, que se utiliza como marcador para diagnosticar la enfermedad e incluso para predecirla de forma temprana. La DM1 representa alrededor del 10% de los casos de diabetes en general, pero es la forma más frecuente en la edad pediátrica, en la que supone más del 90% de los casos.
La DM1 es consecuencia de la interacción entre factores genéticos, inmunológicos y ambientales, por lo que hablamos de una enfermedad poligénica, con patrón de herencia no conocido. Los genes que más influyen en el desarrollo de DM1 son los localizados en la región HLA de clase II del cromosoma 6 (que codifica proteínas relacionadas con el reconocimiento inmune) y que confieren alrededor del 50% del riesgo. En los últimos años se han identificado más de 60 genes fuera de la región HLA asociados con el riesgo de DM1. Sin embargo, en comparación con el HLA, la contribución de todos ellos a desarrollar esta patología es mucho menor.
La diabetes tipo 2 se asocia a la resistencia a la insulina y a menudo a la obesidad, junto con un deterioro progresivo de la función de la célula β del páncreas y la deficiencia relativa de insulina en ausencia de autoanticuerpos relacionados con la diabetes. Se trata, al menos inicialmente, con antidiabéticos orales que estimulan la secreción de insulina.
En adultos, representa alrededor del 90% de todos los casos de diabetes. Desde el punto de vista genético tiene, como la DM1, una base poligénica compleja (genes relacionados con la insulinorresistencia) y es el resultado de las interacciones entre múltiples factores genéticos y medioambientales. Hasta la fecha, se han asociado con riesgo/protección a desarrollar DM2 más de 70 variantes genéticas (polimorfismos) distintas.
LA DM1 ES CONSECUENCIA DE LA INTERACCIÓN ENTRE FACTORES GENÉTICOS, INMUNOLÓGICOS Y AMBIENTALES, POR LO QUE HABLAMOS DE UNA ENFERMEDAD POLIGÉNICA, CON PATRÓN DE HERENCIA NO CONOCIDO
¿Cuáles son las diabetes monogénicas?
Las diabetes monogénicas son mucho más raras que las poligénicas, y se caracterizan por estar causadas por la alteración en un solo gen. Son responsables de alrededor del 1 al 5% de todos los casos de diabetes (figura 1).
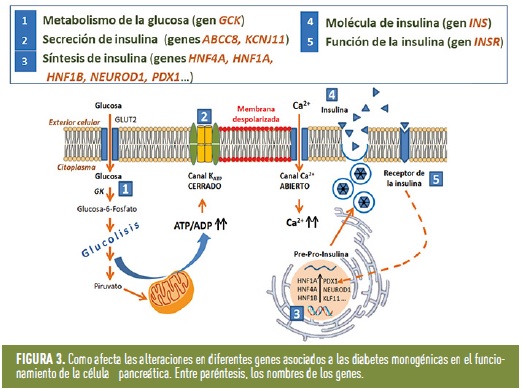
Se han descrito más de 40 genes en los que se han identificado variantes patogénicas asociadas a cuadros clínicos de diabetes (figura 2); son genes implicados en el desarrollo o en la función de la célula β pancreática, o en la propia acción de la insulina (figura 3). Salvo que la mutación sea nueva, en las familias suelen existir varias generaciones afectadas con diagnóstico de diabetes. Por este motivo, hay que pensar en una diabetes monogénica cuando en una familia, al menos tres generaciones seguidas tienen diabetes.
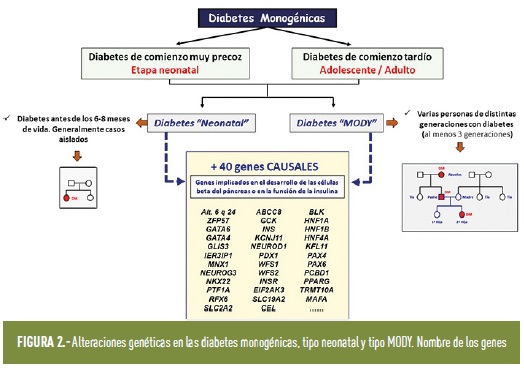
El término diabetes monogénica incluye la diabetes de inicio en la adolescencia o adultos jóvenes, clásicamente conocida como tipo MODY (término adoptado del inglés: Mature Onset Diabetes in the Young), la diabetes de comienzo neonatal, así como otras formas monogénicas menos frecuentes (como la diabetes mitocondrial, cuadros de insulinorresistencia severa y otros síndromes multisistémicos).
La diabetes monogénica tipo MODY corresponde clásicamente a una diabetes no insulinodependiente, con un inicio de la enfermedad antes de los 25 años, sin clínica de cetoacidosis al comienzo, sin autoinmunidad y con varias generaciones seguidas de familiares afectados. La ausencia de autoinmunidad pancreática al debut y una secreción de péptido-C detectable después de 3 a 5 años del diagnóstico, son características compatibles con una diabetes tipo MODY, y son biomarcadores que se utilizan para la identificación de este tipo de diabetes.
En el caso de la diabetes monogénica, el diagnóstico genético de cada subtipo de diabetes es clave a la hora de personalizar el tratamiento del paciente. Así, por ejemplo, en los casos de diabetes monogénica asociada a mutaciones en el gen de la glucoquinasa GCK (MODY2), los pacientes tienen hiperglucemia, o una diabetes leve, que no asocia complicaciones, y precisa únicamente control dietético y ejercicio (excepto en el embarazo), sin la necesidad de fármacos antidiabéticos.
Otros casos interesantes son los causados por mutaciones en los genes HNF1A (MODY3) y HNF4A (MODY1), en los que el riesgo de desarrollo de complicaciones crónicas es equivalente al de pacientes con diabetes tipo 1 o tipo 2. Estos pacientes presentan buena respuesta al tratamiento con antidiabéticos orales (sulfonilureas), y la confirmación genética aconsejaría intentar realizar el cambio de tratamiento si previamente estaban tratándose con insulina.
El resto de pacientes con diabetes monogénica son formas más raras, algunas se tratan con insulina y otras con fármacos orales en función del gen alterado.
La diabetes monogénica neonatal es la que se presenta antes de los 6-8 meses de vida. Este tipo de diabetes se asocia en la mayoría de casos a alteraciones monogénicas (un solo gen), y hasta el presente se han identificado alteraciones en más de 30 genes diferentes. Se diferencian dos tipos de diabetes neonatal: una forma permanente, que requiere tratamiento continuado desde el diagnóstico, y una forma transitoria, que remite pocos meses después de su aparición (antes del primer año de vida), pero que recidiva en la pubertad o más tarde y podría confundirse con una diabetes tipo 2.
Las causas genéticas más frecuentes (alrededor del 60%) se asocian a mutaciones en dos genes: ABCC8 y KCNJ11, que a menudo se acompañan de alteraciones neurológicas. En estos casos el tratamiento recomendado es antidiabéticos orales (las sulfonilureas), mejorando no solo la diabetes, sino también las alteraciones neurológicas. Mutaciones en estos genes también pueden provocar un inicio de diabetes en edades más tardías (después de la pubertad), por lo que ambos genes también están asociados a diabetes monogénica de inicio en el adulto. Otra causa frecuente de diabetes neonatal son mutaciones en el gen de la insulina; pero en este caso, a diferencia de los anteriores, los pacientes necesitarán tratamiento con insulina de forma precoz y de por vida.
Existe una forma de diabetes neonatal siempre transitoria asociada a anomalías en el cromosoma 6 (locus 6q24). Estos pacientes requieren de dosis bajas de insulina, pero hoy en día se plantea que podrían responder bien al tratamiento con sulfonilureas. Otras causas más raras de diabetes neonatal permanente son alteraciones en otros genes como GATA6, GLIS3 o PAX6 asociadas a cuadros sindrómicos más complejos que asocian otras alteraciones, además de la diabetes).
¿Cómo nos puede ayudar la genética?
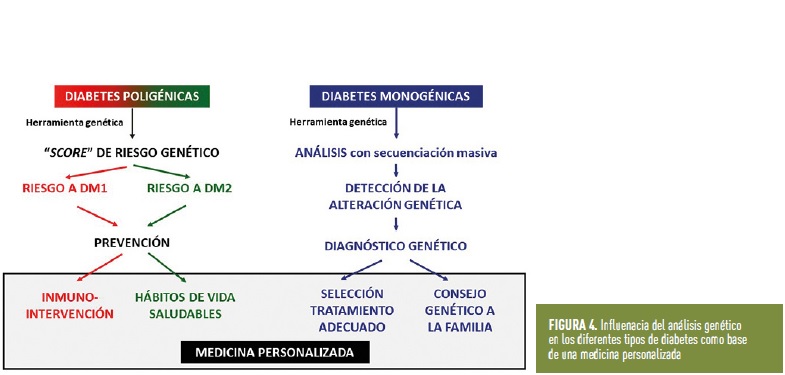
Respecto a las diabetes poligénicas, en la actualidad se está avanzando en la creación de conjuntos de marcadores genéticos asociados a DM1 y DM2 que permitan predecir la predisposición genética de un individuo a desarrollar la enfermedad en un futuro. Son los denominados “score o indicador de riesgo genético” (figura 4). Hoy en día, es muy difícil plantear que se pueda corregir la predisposición a la DM1 y/o DM2. Sin embargo, lo que sí se puede plantear es, para cada persona y en base a sus características genéticas, predecir el grado de riesgo genético, y en las personas con alto riesgo establecer medidas preventivas (por ejemplo, evitar la obesidad y establecer estilos de vida saludable en una persona que tiene riesgo genético de desarrollar diabetes tipo 2). Con respecto a las personas que tienen riesgo genético a desarrollar diabetes tipo 1, se están empezando a utilizar tratamientos, todavía en fase experimental (ensayos clínicos), para evitar la destrucción de las células β del páncreas. La FDA, acaba de aprobar el anticuerpo monoclonal Teplizumab (Tzield) para retrasar la aparición de la diabetes administrado en el estadio 2 de diabetes que logra retrasarlo en poco más de dos años.
Por otro lado, dado que los síntomas clínicos de la diabetes monogénica y de la diabetes tipo 1 o tipo 2 se superponen, existen frecuentes diagnósticos erróneos. Un diagnóstico correcto del tipo de diabetes es de suma importancia ya que como hemos visto previamente tanto el tratamiento y el consejo genético dependen del tipo de diabetes que tenga el paciente. Así, por ejemplo, una diabetes tipo 1 o tipo 2 se trasmite solo en un 10% a los familiares de primer grado (algo superior en el caso de diabetes tipo 2), frente a una probabilidad de transmisión del 50% en el caso de la diabetes monogénica. Además, la detección temprana de la diabetes monogénica en niños y adolescentes permite un tratamiento adecuado desde el inicio de la enfermedad. En este sentido, y dado que la diabetes monogénica es un grupo genéticamente heterogéneo, la capacidad de utilizar las tecnologías de secuenciación masiva (NGS) para secuenciar varios genes simultáneamente es un método potencialmente rentable para aumentar la tasa de diagnóstico molecular en los pacientes afectados.
En resumen, el avance del análisis genético, junto con otros parámetros clínicos y bioquímicos como la presencia de autoanticuerpos, nos van a permitir diagnosticar con mayor precisión a los pacientes con diabetes, aspecto crucial para el control clínico, seleccionar el tratamiento más adecuado y conocer el pronóstico de la enfermedad, posibilitando un consejo genético adecuado a las familias y una medicina más personalizada (figura 4).
BIBLIOGRAFÍA
- DiMeglio LA, Evans-Molina C and Oram RA. Type 1 diabetes. Lancet. 2018, 16;391(10138):2449-2462.
- Wareham NJ. Personalized prevention of type 2 diabetes. Diabetologia. 2022; 65(11):1796-1803.
- Carr ALJ, Evans-Molina C, Oram RA. Precision medicine in type 1 diabetes. Diabetologia. 2022; 65(11):1854-1866. doi:
- Riddle MC, Philipson LH, Rich SS, Carlsson A, Franks PW, Greeley SAW, Nolan JJ, Pearson ER, Zeitler PS, Hattersley AT. Monogenic Diabetes: From Genetic Insights to Population-Based Precision in Care. Reflections From a Diabetes Care Editors’ Expert Forum. Diabetes Care. 2020 Dec;43(12):3117-3128.
- Bonnefond A and Robert K Semple RK. Achievements, prospects and challenges in precision care for monogenic insulin-deficient and insulin-resistant diabetes. Diabetologia. 2022; 65(11):1782-1795.