La diabetes es una enfermedad sistémica que afecta a todas las células del organismo. El exceso de glucosa en sangre y la ausencia de señales dependientes de insulina en las células, bien sea por deficiencia (diabetes tipo 1) o por la existencia de mecanismos de resistencia (diabetes tipo 2), junto con otras alteraciones metabólicas concomitantes, pueden producir a la larga conocidas complicaciones que incluyen alteraciones vasculares, neuritis, afectación de la retina o daño renal, por mencionar solo algunas. Por tanto, no es de extrañar que las células del cerebro también sufran las consecuencias de los desequilibrios metabólicos asociados a la diabetes. Desde hace ya unos años sabemos que existe una relación entre la diabetes y la enfermedad de Alzheimer, la enfermedad neurodegenerativa más frecuente. Más recientemente se han publicado estudios que indican que la preexistencia de diabetes puede aumentar el riesgo de padecer enfermedad de Parkinson.
La enfermedad de Parkinson se produce fundamentalmente por la degeneración de neuronas localizadas en un núcleo del cerebro medio denominado sustancia negra pars compacta, que utilizan la dopamina como neurotransmisor. Estas neuronas proyectan al núcleo estriado situado en el cerebro anterior, donde desempeñan un papel fundamental en la regulación de los movimientos voluntarios. Por tanto, los síntomas principales de la enfermedad de Parkinson son motores: rigidez, temblor de reposo, y dificultad o lentitud en la ejecución de movimientos. No obstante, esta enfermedad se acompaña de comorbilidades como pueden ser depresión o demencia. El factor de riesgo más importante para esta y otras enfermedades neurodegenerativas es la edad, de ahí que sea más frecuente en personas mayores.
Los primeros estudios epidemiológicos que detectaron la existencia de un posible nexo entre diabetes y enfermedad de Parkinson partieron de observaciones aisladas que sugerían que la resistencia a la insulina típica de la diabetes tipo 2 podía estar relacionada con alteraciones en la función neural (Craft and Watson, 2004). Por ejemplo, se habían observado alteraciones de la memoria en pacientes diabéticos, y se había constatado la relativamente frecuente presencia de resistencia a insulina en pacientes parkinsonianos, resistencia que posteriormente se vio ligada a una más rápida progresión de la enfermedad y al desarrollo de deterioro cognitivo y demencia (Bosco et al., 2012). Tanto estudios clínicos como investigaciones de laboratorio realizadas con modelos animales, evidencian la existencia de defectos neuronales en la señalización de insulina asociados al Parkinson. Estos defectos podrían comprometer la función neuroprotectora de la insulina en el cerebro, aunque aún se desconoce si se trata de un efecto primario o de una consecuencia del proceso neurodegenerativo (Athauda and Foltyne, 2016).
En la actualidad, existe evidencia epidemiológica sólida que indica que la diabetes tipo 2 se asocia con un mayor riesgo de padecer la enfermedad de Parkinson y con una aceleración de la progresión del deterioro motor y cognitivo de esta enfermedad (Chohan et al., 2021). Estas observaciones han servido de sustento para las propuestas sobre la utilización de fármacos antidiabéticos en pacientes parkinsonianos, algunos de los cuales se han probado ya en ensayos clínicos (Foltynie and Athauda, 2020).
A pesar de que los estudios epidemiológicos más recientes establecen una clara relación entre diabetes tipo 2 y enfermedad de Parkinson, no está plenamente resuelto si esta relación debería incluir también la diabetes tipo 1. Aunque aún faltan datos concluyentes, se ha propuesto que la asociación entre las dos enfermedades depende más de la duración de la diabetes preexistente que de su tipo (De Pablo-Fernández et al., 2017). Si esto es cierto, los pacientes con diabetes tipo 1 no estarían exentos de presentar un mayor riesgo de desarrollar enfermedad de Parkinson en un futuro.
Otro aspecto importante en relación con lo anterior es la posible influencia del sobrepeso y la obesidad, típicamente asociados a la diabetes tipo 2, como un factor de riesgo adicional. En uno de los primeros estudios epidemiológicos en los que se puso de manifiesto la relación entre la preexistencia de diabetes y el aumento del riesgo de padecer enfermedad de Parkinson ya se apuntó que este riesgo no guardaba relación con la presencia de sobrepeso (Hu et al., 2007). Nuestros estudios realizados con modelos experimentales de diabetes tipo 1 y tipo 2 en ratones sugieren que la obesidad per se, solo presente en los últimos, no contribuye significativamente a la vulnerabilidad neuronal observada en presencia de diabetes (Pérez-Taboada et al., 2020). Aunque esta cuestión debe analizarse con mayor profundidad en humanos, un reciente e interesante estudio muestra que precisamente el mayor riesgo de desarrollar enfermedad de Parkinson en personas previamente con diabetes corresponde a aquellos pacientes con menor peso corporal (Jeong et al., 2020).
Una vez establecida la relación entre la preexistencia de diabetes y el aumento del riesgo de desarrollar enfermedad de Parkinson cabe preguntarse por qué las neuronas dopaminérgicas nigroestriatales son particularmente vulnerables a la neurodegeneración, en comparación con otras neuronas del cerebro. Se sabe que estas neuronas son particularmente sensibles a alteraciones como el estrés oxidativo, la inflamación o las alteraciones en la función mitocondrial, cuya presencia en relación con la diabetes está bien documentada en otros órganos y tejidos. La presencia de estrés oxidativo en el cerebro de ratones diabéticos ha sido documentada recientemente por nuestro grupo (Pérez-Taboada et al., 2020). Es posible que este estrés esté directamente relacionado con la hiperglicemia y la subsiguiente sobrecarga mitocondrial, y agravado por la disminución de la capacidad neuronal de mantener la dopamina almacenada dentro de las vesículas sinápticas, como veremos luego. Este aspecto es importante porque se sabe desde hace décadas que la dopamina libre en el citosol es neurotóxica debido a su gran capacidad oxidativa.
La excepcional sensibilidad selectiva de las neuronas nigroestriatales podría estar relacionada con sus propias características morfo-funcionales, únicas en el cerebro. Se trata neuronas con un axón largo y tremendamente arborizado. En el cerebro de rata, se ha determinado que cada una de estas arborizaciones ocupa alrededor de un seis por ciento del volumen del estriado. Se estima que la longitud total de cada uno de estos axones puede alcanzar los cuatro metros y medio en humanos, y se calcula que, a través de sus varicosidades axonales, cada una de estas neuronas podría establecer entre uno y dos millones y medio de contactos sinápticos con las neuronas del estriado, al menos un orden de magnitud más que otras neuronas complejas del cerebro. Además, estos axones se encuentran desprovistos en su mayor parte de una envoltura de mielina, lo cual hace que la transmisión del impulso nervioso sea más lenta y costosa. Estas características hacen que la demanda de energía que estas neuronas requieren solo para la realización de sus funciones habituales (mantenimiento del citoesqueleto, síntesis de proteínas, transporte axonal, propagación de los impulsos nerviosos, transmisión sináptica, etc.) sea fenomenalmente alta. Por tanto, cualquier situación de estrés que altere el delicado equilibrio entre la demanda y la disponibilidad energética puede ponerlas al borde de la claudicación, mientras que otras neuronas con menor compromiso energético podrían hacer frente a ella poniendo en marcha mecanismos de compensación (Bolam and Pissadaki, 2012).
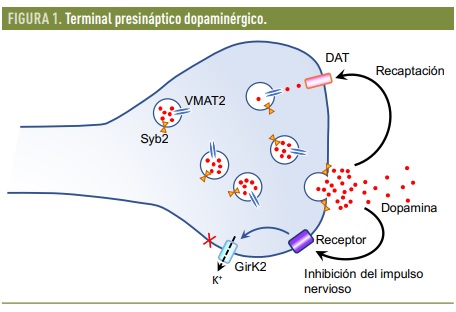
Los desequilibrios metabólicos que acompañan a la diabetes desencadenan alteraciones de la neurotransmisión en los axones de las neuronas dopaminérgicas que inervan el estriado. Estudios realizados por nuestro grupo (Pérez-Taboada et al., 2020) indican que en ratones diabéticos la liberación de dopamina en respuesta a un estímulo nervioso en el estriado está anormalmente elevada. Esto puede estar relacionado con una alteración en los mecanismos de autorregulación de la transmisión sináptica, ya que encontramos niveles reducidos de un canal de potasio, GirK-2, importante para la inhibición del impulso nervioso. Además, detectamos alteraciones en la recaptación de dopamina debido a una disminución de los niveles del transportador presináptico DAT. Finalmente, descubrimos que en el núcleo estriado de los ratones diabéticos existe una disminución importante de los niveles del marcador vesicular Syb-2 y del transportador vesicular de dopamina VMAT2. Esto es particularmente importante porque sugiere que la capacidad de los terminales sinápticos para mantener la dopamina almacenada en vesículas está comprometida. De ser así, la dopamina libre en el citosol del terminal presináptico contribuiría a empeorar el estrés oxidativo generado por la diabetes, aumentando por tanto la posibilidad de daño en las neuronas nigroestriatales. La figura adjunta ofrece una representación esquemática de los mecanismos de neurotransmisión dopaminérgica alterados en los ratones diabéticos.
A pesar de estas deficiencias a nivel molecular, nuestros estudios en animales indican que la diabetes per se no induce deterioro de la actividad motora, pero encajan con observaciones en pacientes que indican una disminución de la función de DAT en personas con diabetes, una disminución de VMAT2 en estadios iniciales de la enfermedad de Parkinson, y la existencia de una pérdida significativa de axones dopaminérgicos previa al diagnóstico de la misma. Será necesario un esfuerzo coordinado entre la investigación básica y la clínica para dilucidar los mecanismos moleculares por los cuales la diabetes favorece los procesos neurodegenerativos asociados a la enfermedad de Parkinson.
REFERENCIAS
Athauda, D., and Foltyne, T. (2016). Insulin resistance and Parkinson’s disease: A new target for disease modification? Prog. Neurobiol. 145-146, 98-120.
Bolam, J.B., and Pissadaki, E.K. (2012). Living on the edge with too many mouths to feed: Why dopaminergic neurons die. Mov. Disord. 27, 1478-1483.
Bosco, D., Plastino, M., Cristiano, D., Colica, C., Ermio, C., De Bartolo, M., Mungari, P., Fonte, G., Consoli, D., Consoli, A., et al. (2012). Dementia is associated with insulin resistance in patients with Parkinson’s disease. J. Neurol. Sci. 315, 39-43.
Chohan, H., Senkevich, K., Patel, R.K., Bestwick, J.P., Jacobs, B.M., Bandres Ciga, S., Gan-Or, Z., and Noyce, A.J. (2021). Type 2 Diabetes as a Determinant of Parkinson’s Disease Risk and Progression. Movement disorders 36, 1420-1429.
Craft, S., and Watson, G.S. (2004). Insulin and neurodegenerative disease: shared and specific mechanisms. The Lancet Neurology 3, 169–178.
De Pablo-Fernández, E., Sierra-Hidalgo, F., Benito-León, J., and Bermejo-Pareja, F. (2017). Association between Parkinson’s disease and diabetes: data from NEDICES study. Acta Neurol. Scand. 136, 732-736.
Foltynie, T., and Athauda, D. (2020). Repurposing anti-diabetic drugs for the treatment of Parkinson’s disease: Rationale and clinical experience. Progress in Brain Research 252, 493-523.
Hu, G., Jousilahti, P., Bidel, S., Antikainen, R., and Toumilehto, J. (2007). Type 2 diabetes and the risk of Parkinson’s disease. Diabetes Care 30, 842-847.
Jeong, S.M., Han, K., Kim, D., Rhee, S.Y., Jang, W., and Shin, D.W. (2020). Body mass index, diabetes, and the risk of Parkinson’s disease. Mov. Disord. 35, 236–244.
Pérez-Taboada, I., Alberquilla, S., Martín, E.D., Anand, R., Vietti-Michelina, S., Tebeka, N.N., Cantley, J., Cragg, S.J., Moratalla, R., and Vallejo, M. (2020). Diabetes Causes Dysfunctional Dopamine Neurotransmission Favoring Nigrostriatal Degeneration in Mice. Movement disorders 35, 1636-1648.