La diabetes constituye un importante factor de riesgo para el desarrollo de numerosas patologías, entre las que destacan las enfermedades cardiovasculares. Patologías como la enfermedad coronaria, el ictus o la enfermedad arterial periférica son directamente responsables del 65% de las muertes atribuibles a la diabetes. Una de las principales manifestaciones de la enfermedad cardiovascular es la insuficiencia cardíaca, es decir, la incapacidad del corazón para bombear sangre de forma eficiente. Diversos estudios internacionales sitúan su prevalencia global entre los individuos diabéticos entorno al 22%, mientras que en España el reciente estudio DIABET-IC estima que hasta un 37% de los individuos con diabetes de tipo 2, la forma más común de diabetes, presenta insuficiencia cardíaca (Rodríguez-Padial et al., 2023).
Las causas de la insuficiencia cardíaca en pacientes diabéticos son diversas. Factores como la aterosclerosis o la hipertensión son con frecuencia los desencadenantes de la disfunción cardíaca en este grupo de pacientes. Sin embargo, no todos los pacientes diabéticos obedecen a este patrón patogénico. Ya en 1972, Rubler describió la presencia de insuficiencia cardíaca e hipertrofia ventricular en pacientes diabéticos en ausencia de enfermedad coronaria (Rubler et al., 1972). Dicha condición es hoy conocida como cardiomiopatía diabética (CMD) y se define como aquella disfunción ventricular que se desarrolla en pacientes diabéticos de manera independiente a la presencia de los típicos factores de riesgo cardiovascular como la hipertensión o la enfermedad coronaria. Actualmente, la CMD es considerada como una entidad clínica propia, aunque las causas que la originan son poco conocidas.
Características fisiopatológicas de la CMD
La manifestación clínica más frecuente y patente de la CMD consiste en una disminución de la función sistólica, la capacidad del corazón para contraerse, que suele ir acompañada de una hipertrofia del ventrículo izquierdo. Sin embargo, en fases tempranas de la enfermedad, la CMD suele caracterizarse también por una disfunción diastólica, es decir, una alteración en la relajación del músculo cardíaco. La disfunción diastólica que suele caracterizar la etapa inicial de la enfermedad resulta difícil de detectar mediante las técnicas ecocardiográficas convencionales, lo que, desafortunadamente, resulta en un infradiagnóstico de la CMD. El uso de nuevas y sofisticadas técnicas de imagen con mayor sensibilidad permiten una mejor evaluación de la función diastólica, lo que facilita un diagnóstico más preciso y precoz de la CMD. Aun así, en parte debido al carácter subclínico con el que cursa la CMD en sus etapas tempranas, los estudios epidemiológicos realizados hasta el momento arrojan cifras de prevalencia muy variables, con un 30%-70% de pacientes diabéticos con CMD.
Las alteraciones funcionales (disfunción diastólica y/o sistólica) y estructurales (hipertrofia ventricular) observadas en el corazón de pacientes con CMD no son muy distintas de aquellas que podemos encontrar en otras patologías cardíacas frecuentes. Es precisamente a nivel celular y metabólico donde, incluso en sus etapas tempranas, es posible encontrar los principales rasgos que definen la CMD de manera inequívoca y la distinguen de otras patologías cardíacas. En humanos, los escasos estudios histopatológicos y bioquímicos realizados a partir de biopsias post mortem de pacientes diabéticos muestran un aumento en el tamaño de las células cardíacas en consonancia con la hipertrofia ventricular, así como la presencia de fibrosis intersticial y/o perivascular en las fases más avanzadas de la enfermedad. Además, y esto constituye un carácter distintivo de la CMD frente a otras enfermedades cardiovasculares, en el miocardio de pacientes diabéticos se ha observado un exacerbado metabolismo lipídico, caracterizado por una excesiva acumulación intracelular de triglicéridos (esteatosis cardíaca) que, paradójicamente, está acompañada de un incremento en el metabolismo oxidativo de los ácidos grasos (Herrero et al., 2006).
La reprogramación metabólica como causa primaria de la CMD
Debido a la dificultad de analizar a nivel celular y molecular el miocardio de pacientes diabéticos, gran parte de los datos de los que se dispone actualmente sobre la etiopatogenia de la CMD proceden de estudios realizados en modelos animales de diabetes tipo 1 o 2. A pesar de las limitaciones que esto pueda suponer en cuanto a la extrapolación a humanos de las datos obtenidos, lo cierto es que los estudios en modelos animales de experimentación han permitido identificar las alteraciones metabólicas que tienen lugar en el corazón de los individuos diabéticos como la causa primaria de la CMD (Figura 1).
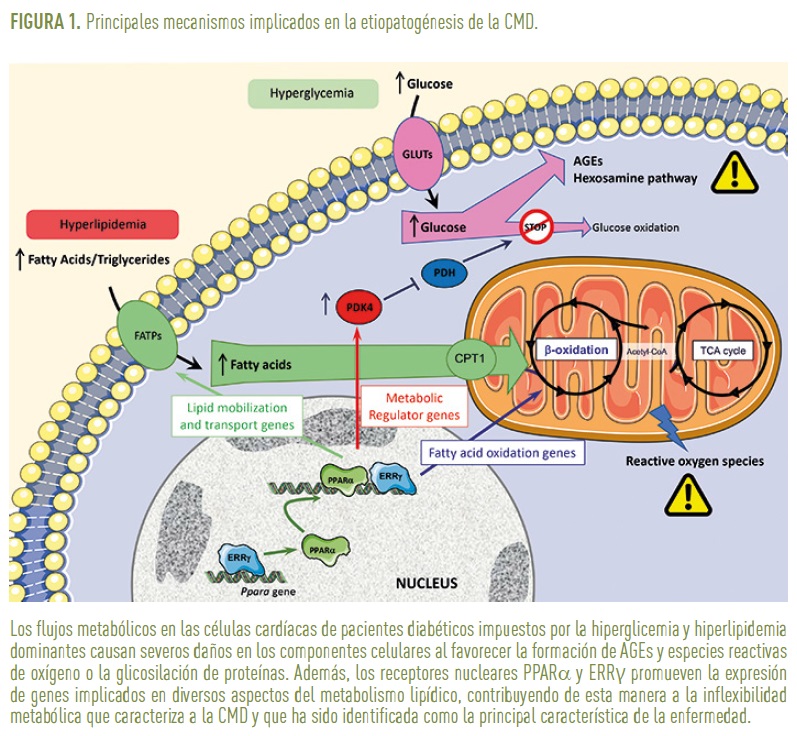
El corazón de individuos sanos se caracteriza por una elevada flexibilidad metabólica que le permite utilizar, en función de su disponibilidad, una diversidad de substratos (ácidos grasos, glucosa o lactato) con el fin de obtener la energía necesaria para su actividad contráctil. Sin embargo, el corazón de individuos con CMD depende casi exclusivamente de los ácidos grasos para su función, en detrimento de la glucosa (Buchanan et al., 2005). Dicha inflexibilidad metabólica está sin duda favorecida por el entorno diabético, en el que a pesar de la hiperglicemia dominante, la disrupción en la vía de señalización de la insulina, bien por la ausencia de esta hormona (diabetes tipo 1) o por la resistencia de los tejidos a su acción (diabetes tipo 2), reduce notablemente la oxidación de glucosa a través de la vía glucolítica. La reducción del flujo glucolítico es el resultado de la inhibición del complejo enzimático PDH (piruvato deshidrogenasa) por PDK4 (piruvato deshidrogenasa quinasa), una proteína reguladora cuya expresión y actividad se hallan incrementadas de manera notable en el corazón de individuos diabéticos. Ante la imposibilidad de ser metabolizada a través de la vía glucolítica, la glucosa que se acumula en las células cardíacas favorece la formación de productos finales de glicación avanzada (AGEs). Dichos productos consisten en proteínas, lípidos o ácidos nucleicos que han sufrido un proceso de glicación al reaccionar con la glucosa existente en la célula. La interacción de los AGEs con sus receptores específicos (RAGEs) promueve la formación de colágeno y otras proteínas de matriz extracelular, contribuyendo de esta manera a la fibrosis que caracteriza la CMD. La glucosa acumulada es también redirigida hacia otras vías minoritarias, como la vía de las hexosaminas, cuyos productos finales favorecen la anormal glicosilación de proteínas, alterando su función. Todas estas modificaciones de los componentes celulares resultan, en última instancia, en una alteración de la capacidad contráctil de las células cardíacas (Zamora and Villena, 2019).
La ausencia o disminución de la señalización por insulina en el tejido adiposo genera además una lipólisis incontrolada que contribuye a la lipidemia característica de los individuos diabéticos. El incremento de lípidos circulantes resultante da lugar a un desmesurado flujo de ácidos grasos hacia el interior de las células cardíacas cuyas mitocondrias son incapaces de oxidarlos de manera eficiente. Por una parte, esto favorece la acumulación intracelular de triglicéridos, dando lugar a la esteatosis cardíaca característica de la CMD; y además promueve la generación de especies reactivas de oxígeno, las cuales dañan también los componentes celulares e impiden así la correcta función de las células cardíacas.
La inflexibilidad metabólica y el exacerbado metabolismo lipídico característico de la CMD no es solo resultado de un aumento del flujo metabólico debido al incremento de la disponibilidad de substratos y la actividad de ciertos enzimas. Estudios recientes en modelos de ratón diabéticos (y obesos) han puesto de manifiesto que dicha inflexibilidad metabólica tiene como base una completa reprogramación del metabolismo a nivel genético. Así, el análisis del perfil de expresión génica (transcriptoma) del corazón de ratones con CMD muestra un destacable incremento en la expresión de genes implicados en todos los aspectos del metabolismo lipídico, incluyendo transporte, síntesis, lipólisis y b-oxidación, tanto mitocondrial como peroxisomal (Glyn-Jones et al., 2007; Lasheras et al., 2016). Además, en consonancia con una reducción el metabolismo de la glucosa, se observa también una disminución en la expresión de genes de la vía glucolítica.
LA INFLEXIBILIDAD METABÓLICA PRESENTE EN EL CORAZÓN DE RATONES DIABÉTICOS Y OBESOS CON CARDIOMIOPATÍA DIABÉTICA TIENE COMO BASE UNA COMPLETA REPROGRAMACIÓN DEL METABOLISMO A NIVEL GENÉTICO
¿Qué hace posible la expresión coordinada de todos estos genes?
Los esfuerzos en investigación por desentrañar los factores patogénicos de la CMD han permitido identificar a los receptores nucleares de hormonas PPARα (Peroxisome Proliferator –Activated Receptor α) y ERRγ (Estrogen-Related Receptor γ), cuya expresión se halla incrementada en el tejido cardíaco de ratones con CMD, como dos de los posibles factores responsables de la reprogramación metabólica (Figura 1). PPARα es conocido por su papel en la regulación de la expresión de genes implicados en el transporte y oxidación de ácidos grasos en diversos tejidos. Su contribución a la patogénesis de la CMD viene apoyada por estudios en ratones modificados genéticamente en los que la sobreexpresión de PPARα exclusivamente en células cardíacas es suficiente para reproducir las principales alteraciones que caracterizan la CMD. Esto incluye un aumento de la oxidación de ácidos grasos, una disminución de la oxidación de glucosa, el desarrollo de esteatosis cardíaca y, obviamente, disfunción contráctil (Finck et al., 2002). Por otra parte, un análisis in silico del transcriptoma de tejido cardíaco obtenido de ratones diabéticos permitió identificar ERRγ como uno de los principales nodos reguladores responsables de la activación de las redes de genes implicados en el fenotipo metabólico de la CMD (Lasheras et al., 2016). Su contribución a la etiopatogénesis de la CMD está respaldada por estudios in vitro en los que la sobreexpresión de ERRγ en células cardiacas en cultivo se mostró suficiente para inducir la expresión de genes implicados en el metabolismo lipídico incluyendo a PPARα, incrementar la oxidación de ácidos grasos e inducir hipertrofia celular (Lasheras et al., 2016). Sin embargo, hasta el momento, los estudios in vivo no han podido corroborar de manera inequívoca la contribución de ERRγ al desarrollo de la CMD. Esto es debido, primordialmente, al hecho de que la sobreexpresión específica de ERRγ en corazón de ratones modificados genéticamente induce de forma rápida una cardiopatía dilatada que resulta en la muerte prematura de los animales pocas semanas después de su nacimiento, impidiendo su estudio en un contexto de diabetes (Lasheras et al., 2021). En cualquier caso, este estudio demuestra que niveles anormalmente altos de ERRγ en cardiomiocitos tiene efectos perjudiciales sobre el normal desarrollo y funcionamiento del corazón. Esto, junto con su papel en la expresión de genes relacionados con el catabolismo de lípido, encaja con un posible papel de ERRγ en la patogénesis de la CMD.
LA CARDIOMIOPATÍA DIABÉTICA SE DEFINE COMO AQUELLA DISFUNCIÓN VENTRICULAR QUE SE DESARROLLA EN PACIENTES DIABÉTICOS DE MANERA INDEPENDIENTE A LA PRESENCIA DE LOS TÍPICOS FACTORES DE RIESGO CARDIOVASCULAR
Tratamiento de la CMD
En la actualidad, no existe un tratamiento específico para la CMD. Las medidas terapéuticas utilizadas incluyen fármacos para la mejora del control glucémico (metformina, agonistas del receptor de GLP-1, inhibidores de DPP4, insulina, etc.), fármacos para el control de la dislipemia (estatinas) o fármacos para el tratamiento de la insuficiencia cardíaca (inhibidores de los receptores β-adrenérgicos, inhibidores de la enzima convertidora de angiotensina o antagonistas de los receptores de angiotensina II). Sin embargo, la identificación de los mecanismos moleculares implicados en la patogénesis de la CMD abre la puerta al desarrollo de nuevos fármacos para su tratamiento. Inhibidores del catabolismo lipídico, como la Perhexilina (inhibidor de la carnitina-palmitoil transferasa) o la Trimetazidina (inhibidor de la 3-ketoacil-coenzima A tiolasa) han demostrado efectos positivos sobre la insuficiencia cardíaca en pequeños ensayos clínicos, aunque ninguno incluía pacientes con CMD, por lo que su eficacia para el tratamiento de esta patología queda aún por determinar (Nickel et al., 2013). Por otra parte, el uso de moléculas con capacidad para antagonizar la actividad de PPARα o ERRγ se revela como una atractiva posibilidad. Sin embargo, a la discutible especificidad, eficacia y biodisponibilidad de los antagonistas existentes hasta el momento, hay que añadir el hecho de que tanto PPARα como ERRγ son indispensables para la correcta función cardíaca, por lo que el uso de estos fármacos podría no estar exento de efectos segundarios indeseables o incluso nocivos. En este sentido, la búsqueda de nuevos compuestos con capacidad de antagonizar parcialmente la actividad de PPARα y/o ERRγ ofrece, pese a su dificultad, una oportunidad para el futuro desarrollo de una nueva generación de fármacos para el tratamiento específico de la CMD.
Referencias
- Buchanan, J., Mazumder, P.K., Hu, P., Chakrabarti, G., Roberts, M.W., Yun, U.J., Cooksey, R.C., Litwin, S.E., Abel, E.D., 2005. Reduced Cardiac Efficiency and Altered Substrate Metabolism Precedes the Onset of Hyperglycemia and Contractile Dysfunction in Two Mouse Models of Insulin Resistance and Obesity. Endocrinology 146, 5341–5349.
- Finck, B.N., Lehman, J.J., Leone, T.C., Welch, M.J., Bennett, M.J., Kovacs, A., Han, X., Gross, R.W., Kozak, R., Lopaschuk, G.D., Kelly, D.P., 2002. The cardiac phenotype induced by PPARα overexpression mimics that caused by diabetes mellitus. J. Clin. Invest. 109, 121–130.
- Glyn-Jones, S., Song, S., Black, M.A., Phillips, A.R.J., Choong, S.Y., Cooper, G.J.S., 2007. Transcriptomic analysis of the cardiac left ventricle in a rodent model of diabetic cardiomyopathy: molecular snapshot of a severe myocardial disease. Physiological Genomics 28, 284–293.
- Herrero, P., Peterson, L.R., McGill, J.B., Matthew, S., Lesniak, D., Dence, C., Gropler, R.J., 2006. Increased Myocardial Fatty Acid Metabolism in Patients With Type 1 Diabetes Mellitus. Journal of the American College of Cardiology 47, 598–604.
- Lasheras, J., Pardo, R., Velilla, M., Poncelas, M., Salvatella, N., Simó, R., Ruiz-Meana, M., Zamora, M., Villena, J.A., 2021. Cardiac-Specific Overexpression of ERRγ in Mice Induces Severe Heart Dysfunction and Early Lethality. IJMS 22, 8047.
- Lasheras, J., Vilà, M., Zamora, M., Riu, E., Pardo, R., Poncelas, M., Cases, I., Ruiz-Meana, M., Hernández, C., Feliu, J.E., Simó, R., García-Dorado, D., Villena, J.A., 2016. Gene expression profiling in hearts of diabetic mice uncovers a potential role of estrogen-related receptor γ in diabetic cardiomyopathy. Molecular and Cellular Endocrinology 430, 77–88.
- Nickel, A., Löffler, J., Maack, C., 2013. Myocardial energetics in heart failure. Basic Res Cardiol 108, 358.
- Rodríguez‐Padial, L., Pérez, A., Anguita Sánchez, M., Barrios, V., Gimeno-Orna, J.A., Muñiz, J., 2023. Characteristics of women with type 2 diabetes and heart failure in Spain. The DIABET-IC study. Cardiol J. VM/OJS/J/86927.
- Rubler, S., Dlugash, J., Yuceoglu, Y.Z., Kumral, T., Branwood, A.W., Grishman, A., 1972. New type of cardiomyopathy associated with diabetic glomerulosclerosis. The American Journal of Cardiology 30, 595–602.
- Zamora, M., Villena, J.A., 2019. Contribution of Impaired Insulin Signaling to the Pathogenesis of Diabetic Cardiomyopathy. IJMS 20, 2833.







