El término cannabis se usa para denominar una conocida planta, o una preparación a partir de esta que consumida de distintas maneras, especialmente fumada, tiene propiedades estupefacientes o terapéuticas. Esta planta, de nombre científico Cannabis sativa, sintetiza en sus tricomas una serie de compuestos orgánicos con función defensiva que se denominan cannabinoides, o más específicamente fitocannabinoides para diferenciarlos de otras moléculas producidas por los animales (endocannabinoides) o los sintetizados en laboratorio (cannabinoides sintéticos). La planta fabrica un gran número de diferentes fitocannabinoides, pero solo unos pocos han sido estudiados. Destacan el tetrahidrocannabinol (THC) y el cannabidiol (CBD), los dos más abundantes en la planta. El THC es el responsable de los efectos psicotrópicos del cannabis, así como induce apetito y tiene propiedades anti-nociceptivas (alivia el dolor) y anti-inflamatorias; y el segundo, el CBD, tiene también propiedades anti-inflamatorias y anti-oxidantes, con la ventaja de que no presenta propiedades psicotrópicas.
Mientras que los efectos psicotrópicos han provocado que el cannabis sea una sustancia ilegal durante la mayor parte del siglo XX y parte del XXI en casi todo el mundo, la evidencia sobre sus propiedades terapéuticas ha promovido en los últimos 20 años un mayor estudio de estos compuestos, dando lugar al desarrollo de lo que ahora se conoce como cannabis medicinal, así como a un movimiento pro-legalización de su uso recreacional (1). Sin embargo, la creciente legalización de su uso en muchos países y las propiedades terapéuticas de algunos compuestos presentes en la planta no debería confundir ni esconder una realidad que tiene tras de sí evidencia científica. El consumo de cannabis lleva asociado un riesgo de adicción (2). Entre el 10 y el 20% de los consumidores de cannabis pierden el control sobre su consumo, interfiriendo en sus obligaciones personales y laborales y sufriendo esfuerzos infructuosos para dejarlo. El consumo de cannabis también provoca un desarrollo anormal cerebral, tanto mayor cuanto más temprano se inicia su consumo. Hasta aproximadamente los 21 años, el cerebro está en un estadio de desarrollo, siendo este más vulnerable que un cerebro maduro a los efectos de sustancias que interfieran en su funcionamiento. Esto está asociado a un mayor riesgo de desarrollar enfermedades mentales como ansiedad, depresión, psicosis y esquizofrenia (2).
EL SISTEMA ENDOCANNABINOIDE DEL ORGANISMO ¿QUÉ ES Y PARA QUÉ SIRVE?
La búsqueda de los mecanismos por los cuales el cannabis ejerce sus efectos psicotrópicos en los seres humanos llevó al descubrimiento, en los años 90 del pasado siglo, de los denominados receptores cannabinoides, llamados así precisamente por mediar los efectos del cannabis. Se conocen dos tipos principales, CB1 y CB2, y forman parte de una familia de receptores transmembrana denominados GPCR (receptores acoplados a proteína G). Se encuentran en las membranas plasmáticas y mitocondriales de muchas células de nuestro organismo.
El THC del cannabis tiene capacidad para activar estos receptores, desencadenando una cascada molecular de eventos, una respuesta, similar a la que produciría su activación normal. Pero CB1 y CB2 no forman parte de ningún sistema natural de respuesta a fitocannabinoides, sino que en realidad forman parte de un sistema interno de señalización entre células y que tiene múltiples funciones. Este sistema de señalización se denomina sistema endocannabinoide y consta, junto con los receptores CB1 y CB2, de los endocannabinoides, que son las sustancias endógenas que activan de manera natural CB1 y CB2, y de las enzimas implicadas en la síntesis y degradación de los endocannabinoides (3). La función del sistema endocannabinoide dentro de nuestro organismo es homeostática o moduladora, o sea, regula la magnitud de otros procesos de señalización entre células para impedir que los efectos sean deletéreos, asegurar que haya una adecuada retroalimentación negativa y que la comunicación entre células sea fina y efectiva. El ejemplo más paradigmático es quizás el de los receptores CB1 que se encuentran en neuronas postsinápticas y cuya función es, mediante un mecanismo de retroalimentación negativa, regular la transmisión de la señal eléctrica entre neuronas (3).
LA FUNCIÓN DEL SISTEMA ENDOCANNABINOIDE DENTRO DE NUESTRO ORGANISMO ES HOMEOSTÁTICA O MODULADORA, O SEA, REGULA LA MAGNITUD DE OTROS PROCESOS DE SEÑALIZACIÓN ENTRE CÉLULAS PARA IMPEDIR QUE LOS EFECTOS SEAN DELETÉREOS, ASEGURAR QUE HAYA UNA ADECUADA RETROALIMENTACIÓN NEGATIVA Y QUE LA COMUNICACIÓN ENTRE CÉLULAS SEA FINA Y EFECTIVA
ENDOCANNABINOIDES, METABOLISMO Y CONTROL GLUCÉMICO
El receptor CB1 y la mayoría de componentes del sistema endocannabinoide fueron inicialmente descubiertos en cerebro, dado que los efectos psicotrópicos llevaron a buscarlo ahí. Pero con el paso del tiempo se ha visto que este sistema, incluido el receptor CB2, que fue descubierto en tejido inmune, es prácticamente ubicuo en el organismo, y desarrolla su función homeostática en casi todos los órganos. Es más, aparte de su función moduladora de la señalización a nivel celular, parece cumplir una función global a nivel metabólico, y que está relacionada con el ahorro energético y el almacenamiento de energía (4). Actualmente está claro que su activación promueve la ingesta, especialmente de comidas ricas en grasas, la lipogénesis en hígado y tejido adiposo, e inhibe el gasto energético y la termogénesis. Para llevar a cabo estas funciones se encuentra presente en tejidos metabólicamente relevantes como el tejido adiposo, el tracto gastrointestinal, el hígado, el músculo y el páncreas endocrino, en terminales del sistema nervioso periférico que controlan estos órganos y otros como la grasa parda, y en estructuras cerebrales implicadas en la ingesta de alimentos, como el hipotálamo, el tronco cerebral y el sistema de recompensa (4). Por tanto, podríamos decir que el sistema endocannabinoide ajusta el comportamiento y el metabolismo a la disponibilidad de alimentos, promoviendo el ahorro energético en situaciones de escasez. Esto resulta ventajoso cuando el acceso al alimento es limitado o no predecible, como ha ocurrido durante gran parte del pasado de la humanidad, pero se convierte en peligroso cuando la comida es abundante, como en la época actual, favoreciendo el desarrollo de obesidad y enfermedades metabólicas asociadas, como la diabetes.
Como parte del control que ejerce en el metabolismo, este sistema también controla el metabolismo de la glucosa, y lo hace mediante la inducción de la secreción de insulina pancreática, la disminución del aclaramiento de insulina hepática, y el aumento de la lipogénesis inducida por insulina en hígado y músculo esquelético. En resumen, podemos decir que, como parte de un papel clave en el metabolismo, el sistema endocannabinoide es muy importante para el control de los niveles de glucosa en sangre (4).

USO DE CANNABIS EN PERSONAS CON DIABETES ¿HAY MÁS RIESGO QUE EN PERSONAS SANAS?
Todo lo dicho anteriormente pone de manifiesto que fitocannabinoides como el THC, que se encuentra en altas proporciones en el cannabis, tienen capacidad de alterar la señalización natural endógena mediada por endocannabinoides que regula el control glucémico. Por tanto, sería esperable que una persona con diabetes, que tiene dañado el sistema natural que controla el nivel de glucosa en sangre, sea más vulnerable a las interferencias que produce el cannabis. Y también sería esperable que el cannabis interfiriera sobre los tratamientos médicos que tienen como objetivo un adecuado control glucémico en personas con diabetes.
Existen en la literatura científica estudios que confirman estas hipótesis. El uso de cannabis altera la motilidad intestinal y causa hiperémesis, incrementando el riesgo de cetoacidosis diabética en personas con diabetes tipo 1 (5). También parece estar asociado a mayores niveles de hemoglobina glicosilada y a una peor autogestión de la enfermedad. En personas con diabetes tipo 2, el riesgo de desarrollar complicaciones (enfermedad cardiovascular, enfermedad arterial coronaria, enfermedad renal) parece ser mayor en aquellas que consumen cannabis. Por otro lado, el consumo crónico de cannabis también ha sido asociado a adiposidad visceral y resistencia a insulina en tejido adiposo (6). Sin embargo, no parece que el consumo de cannabis per se induzca la aparición de diabetes, aunque hay estudios que han puesto de manifiesto que los consumidores crónicos de cannabis tienen islotes pancreáticos hipertróficos que funcionan peor que los de las personas sanas. En resumen, el consumo de cannabis podría no provocar diabetes, pero no es recomendable para adolescentes y adultos que ya tienen diabetes. En personas con diabetes su uso regular está asociado con empeoramiento del control glucémico, más complicaciones relacionadas con la diabetes y peor autocontrol de la enfermedad, dificultando una adecuada monitorización de la glucosa, adherencia a la medicación, y cumplimiento de recomendaciones en dieta y actividad física.
EN PERSONAS CON DIABETES EL USO REGULAR DE LOS CANNABINOIDES ESTÁ ASOCIADO CON EMPEORAMIENTO DEL CONTROL GLUCÉMICO, MÁS COMPLICACIONES RELACIONADAS CON LA DIABETES Y PEOR AUTOCONTROL DE LA ENFERMEDAD, DIFICULTANDO UNA ADECUADA MONITORIZACIÓN DE LA GLUCOSA, ADHERENCIA A LA MEDICACIÓN, Y CUMPLIMIENTO DE RECOMENDACIONES EN DIETA Y ACTIVIDAD FÍSICA
CANNABIS, PRINCIPIOS ACTIVOS DEL CANNABIS Y TRATAMIENTO DE LA DIABETES
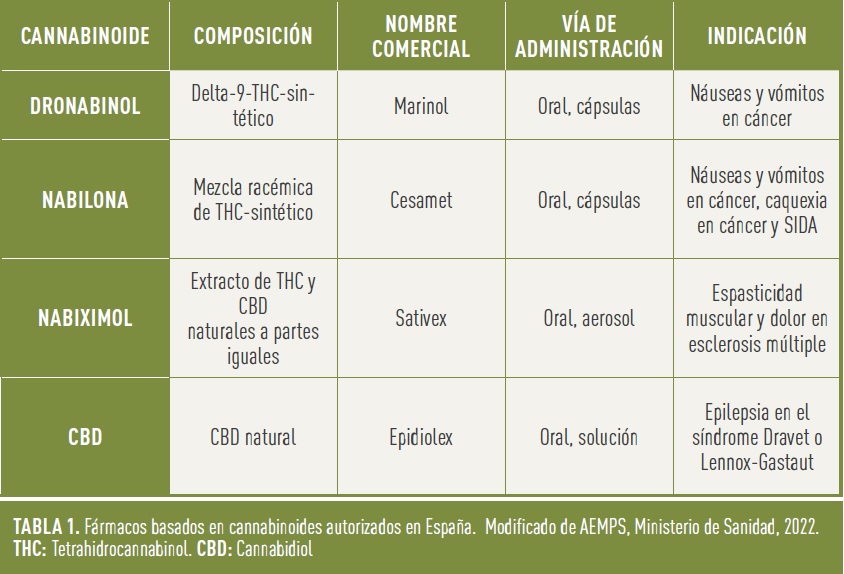
Como se ha comentado al principio de este artículo, determinados fitocannabinoides, como el THC y el CBD, tienen propiedades terapéuticas y, si bien el consumo de cannabis como tal resulta más perjudicial que beneficioso, el aislamiento de estos principios activos y su correcta dosificación pueden tener efectos positivos en determinadas circunstancias. De hecho, desde hace tiempo están autorizados diversos fármacos a base de THC y/o CBD que se usan en el tratamiento de determinadas enfermedades (Tabla 1). Nabilona y dronabinol son fármacos cuyo principio activo es THC de origen sintético, y se usan para tratar las náuseas y vómitos asociadas a la quimioterapia en cáncer y la caquexia asociada a enfermedades como el SIDA. Otros fármacos más recientes son nabiximol, que es una combinación de THC y CBD, y que está indicado para la espasticidad moderada o grave en pacientes con esclerosis múltiple, y un preparado de CBD purificado que se usa para tratar la epilepsia asociada al síndrome Dravet o Lennox-Gastaut.
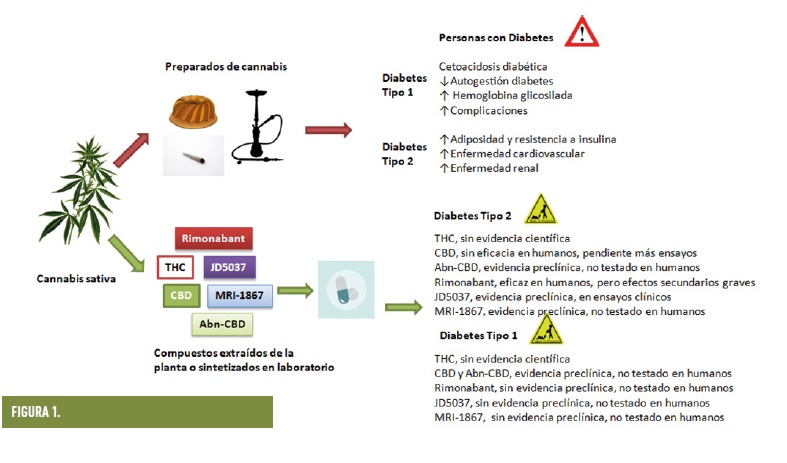
Hemos comentado anteriormente que la activación del receptor CB1 promueve el ahorro de energía y su almacenamiento, y que ello favorece por tanto la obesidad y las enfermedades metabólicas asociadas, como la diabetes. De esto se deduce que el THC, que activa CB1, no puede ayudar a combatir la obesidad o la diabetes; sin embargo, bloquear CB1 podría ser efectivo contra estas enfermedades. De hecho, rimonabant es un fármaco, un antagonista de CB1, que demostró en ensayos clínicos que es capaz de disminuir peso y mejorar el perfil metabólico en personas con obesidad y diabetes (7). Se llegó a comercializar como fármaco para tratar la obesidad asociada a complicaciones metabólicas en 2008 en España. Sin embargo, fue retirado del mercado debido al aumento de complicaciones psiquiátricas en los pacientes que lo tomaban. El hecho de que se haya comprobado que la mayoría de beneficios metabólicos de rimonabant están mediados por el bloqueo de CB1 a nivel periférico ha llevado a continuar el desarrollo de fármacos basados en esta molécula, pero que no atraviesen la barrera hematoencefálica. Se ha desarrollado una segunda generación de antagonistas de CB1, con varios fármacos que ahora están en fases I y II en ensayos clínicos, como JD5037, e incluso está en marcha el desarrollo de una tercera generación que añade al hecho de ser de acción periférica la habilidad de ser duales, o sea, de actuar sobre dos dianas terapéuticas distintas pero con efectos aditivos (8). Es el caso de fármacos como MRI-1867 y MRI-1569, que son antagonistas híbridos de CB1 e iNOS. iNOS genera especies reactivas de nitrógeno pro-inflamatorias, y se le considera un factor que contribuye a procesos como la resistencia a insulina. Por tanto, su bloqueo junto al de CB1 podría contribuir a una mayor eficacia anti-diabética. Experimentos preclínicos avalan la eficacia de estos antagonistas duales, pero aún está pendiente su paso a ensayos clínicos (8).

La mayoría de las enfermedades progresivas crónicas, como la diabetes, son complejas y multifactoriales y un número cada vez mayor de ensayos clínicos basados en el paradigma farmacológico tradicional de “un fármaco-una proteína-una enfermedad” no logran alcanzar eficacia clínica. Por ello, en los últimos años se está defendiendo con fuerza la necesidad de una estrategia terapéutica multi-diana. Este razonamiento es el que está detrás de los antagonistas duales CB1/iNOS, pero también de otros fármacos anti-diabéticos, como los agonistas duales GLP1/GIP. Un ejemplo de esto es tirzepatida (9), que acaba de ser aprobado tanto en USA como en la Unión Europea para la diabetes tipo 2 y se encuentra en valoración para el tratamiento de la obesidad.
Respecto al CBD, que tiene propiedades anti-inflamatorias y anti-oxidantes, el único ensayo clínico realizado hasta ahora no ha tenido resultados positivos (10), aunque existe un cuerpo de estudios preclínicos que avalan un posible efecto beneficioso del CBD para esta enfermedad. Se requieren más ensayos clínicos para poder establecer con mayor precisión si esta molécula tiene o no interés clínico para el manejo de la diabetes.
En resumen, los fármacos basados en cannabinoides, como los bloqueadores de los receptores CB1 periféricos, tienen potencial para tratar la diabetes y están en fase temprana de ensayo clínico, con visos de poder llegar en un futuro a ser parte del arsenal terapéutico contra la diabetes.

REFERENCIAS
- https://www.fundacion-canna.es/el-boom-de-la-industria-del-cannabis- medicinal
- Volkow ND, Baler RD, Compton WM, Weiss SR. Adverse health effects of marijuana use. N Engl J Med. 2014 Jun 5;370(23):2219-27. doi: 10.1056/NEJMra1402309.
- Bermudez-Silva FJ, Viveros MP, McPartland JM, Rodriguez de Fonseca F. The endocannabinoid system, eating behavior and energy homeostasis: the end or a new beginning? Pharmacol Biochem Behav. 2010 Jun;95(4):375-82. doi: 10.1016/j.pbb.2010.03.012.
- Mazier W, Saucisse N, Gatta-Cherifi B, Cota D. The Endocannabinoid System: Pivotal Orchestrator of Obesity and Metabolic Disease. Trends Endocrinol Metab. 2015 Oct;26(10):524-537. doi: 10.1016/j.tem.2015.07.007.
- Kinney GL, Akturk HK, Taylor DD, Foster NC, Shah VN. Cannabis Use Is Associated With Increased Risk for Diabetic Ketoacidosis in Adults With Type 1 Diabetes: Findings From the T1D Exchange Clinic Registry. Diabetes Care. 2020 Jan;43(1):247-249. doi: 10.2337/dc19-0365.
- Muniyappa R, Sable S, Ouwerkerk R, Mari A, Gharib AM, Walter M, Courville A, Hall G, Chen KY, Volkow ND, Kunos G, Huestis MA, Skarulis MC. Metabolic effects of chronic cannabis smoking. Diabetes Care. 2013 Aug;36(8):2415-22. doi: 10.2337/dc12-2303.
- Scheen AJ, Finer N, Hollander P, Jensen MD, Van Gaal LF; RIO-Diabetes Study Group. Efficacy and tolerability of rimonabant in overweight or obese patients with type 2 diabetes: a randomised controlled study. Lancet. 2006 nov 11;368(9548):1660-72. doi: 10.1016/S0140-6736(06)69571-8. Erratum in: Lancet. 2006 nov 11;368(9548):1650.
- Cinar R, Iyer MR, Kunos G. The therapeutic potential of second and third generation CB1R antagonists. Pharmacol Ther. 2020 apr;208:107477. doi: 10.1016/j.pharmthera.2020.107477.
- Baggio LL, Drucker DJ. Glucagon-like peptide-1 receptor co-agonists for treating metabolic disease. Mol Metab. 2021 apr;46:101090. doi: 10.1016/j.molmet.2020.101090.
- O’Sullivan SE, Jensen SS, Nikolajsen GN, Bruun HZ, Bhuller R, Hoeng J. The therapeutic potential of purified cannabidiol. J Cannabis Res. 2023 jun 13;5(1):21. doi: 10.1186/s42238-023-00186-9.







