Entender la resistencia a la insulina es fundamental para tener una visión holística tanto del diagnóstico del tipo de diabetes como de su tratamiento. Los términos «resistencia a la insulina» y «sensibilidad a la insulina» son complementarios y opuestos. Se refieren a la capacidad relativa de la insulina para regular la metabolización de la glucosa sistémica. Cuanto más eficiente es el proceso de metabolización de la glucosa a una misma concentración de insulina, más sensible (menos resistente) a la insulina será el individuo1,2. En presencia de resistencia a la insulina en los tejidos periféricos diana (principalmente el músculo, el hígado y el tejido adiposo), la respuesta “normal” a la acción de dicha hormona se halla disminuida. En estas circunstancias se desencadena un mecanismo compensador de aumento en la producción y liberación de la insulina, insulina circulante, (lo que se conoce como hiperinsulinismo), que en las primeras fases puede ser eficiente y resultar en una glucemia normal. Sólo cuando la hiperinsulinemia compensadora resulte insuficiente para mantener la homeostasis aparecerá un ligero aumento en la glucemia (lo que se conoce como intolerancia a la glucosa), y posteriormente, si evoluciona la resistencia y la compensación no es suficiente, se desarrolla la diabetes tipo 21,3.
Muchos de los efectos adversos de la resistencia a la insulina son secundarios a la hiperinsulinemia compensatoria que actúa en los tejidos sensibles a la insulina. El efecto fisiológico de la insulina es diferente en cada tejido y esta complejidad es crucial para entender estos efectos adversos desencadenados por la resistencia a la insulina/hiperinsulinemia compensatoria y en la expresividad de la enfermedad. De hecho, existen diferencias importantes en las características de las curvas dosis-respuesta por parte de los diferentes tejidos sensibles a la insulina, e incluso dentro de un mismo tejido puede variar el grado de resistencia a la insulina según la ruta metabólica que se estimule.2
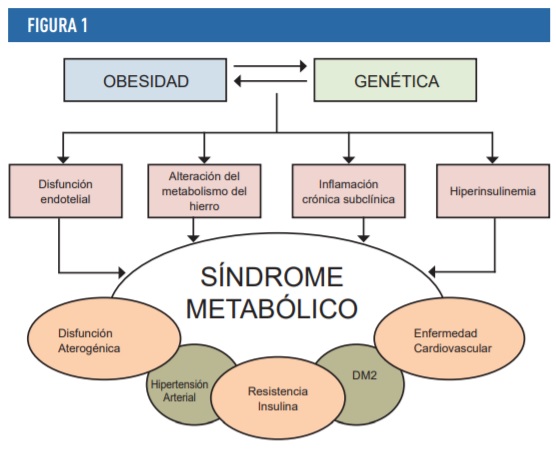
Hace ya más de 30 años, en 1988, Gerald Reaven compendió diferentes observaciones previas de diferentes autores según las cuales la obesidad abdominal, la hipertensión arterial y la dislipemia se agregaban en algunos individuos con resistencia a la insulina y/o hiperinsulinemia, abocándolos a una alteración de la tolerancia a la glucosa / diabetes mellitus tipo 2. Denominó a esta asociación, inicialmente, como síndrome X (de etiología incierta) y posteriormente el término que ha tenido más éxito ha sido el de “síndrome metabólico”, reconociéndose extensivamente como un factor de riesgo para presentar enfermedades cardiovasculares1. Los principales componentes de este síndrome metabólico son los siguientes:
Obesidad abdominal
La obesidad, particularmente la obesidad abdominal, se asocia con resistencia a la insulina ya que se asocia a defectos tanto en la utilización periférica de glucosa como de los ácidos grasos, lo que a menudo conduce al desarrollo de diabetes tipo 21,4.
La predisposición genética, la falta de ejercicio y la distribución de grasa corporal afectan a la probabilidad de que un sujeto con obesidad desarrolle diabetes tipo 2 o enfermedad cardiovascular5,6.
Hipertensión arterial
La activación del sistema nervioso simpático por la hiperinsulinemia, junto con una mayor retención de sodio a nivel renal, probablemente contribuyen a la mayor prevalencia de hipertensión esencial en individuos resistentes a la insulina3.
Se ha relacionado el desarrollo de hipertensión arterial con una mayor concentración de insulina plasmática en ayunas y también con el índice de resistencia a la insulina (conocido como HOMA-IR que resulta de multiplicar la glucemia e insulinemia en ayunas).
De esta manera, las personas con mayor valor de insulina en ayunas tienen un 54% de riesgo de desarrollar hipertensión arterial y aquellos con mayor índice HOMA-IR un riesgo del 43%7. Además, este riesgo parece que es mayor en las mujeres que en los hombres6. Se ha estipulado que esta diferencia se deba a la diferencia de valores de la insulina en ayunas en las mujeres y también a la diferencia con la distribución de la grasa corporal.
Dislipemia
La dislipemia es una de las complicaciones más frecuentes de la resistencia a la insulina. Se caracteriza por una dislipemia aterogénica que comporta unas concentraciones de triglicéridos elevados en plasma, bajas concentraciones de HDL colesterol junto con una elevación de las lipoproteínas de baja densidad (LDL) en el contexto de una elevada lipemia postprandial (aumento de lípidos circulantes después de las comidas) 8.
La hipertrigliceridemia se asocia a una reducción en los valores de HDL y promueve la formación de colesterol LDL a partir de las partículas VLDL (con mayor potencial aterogénico por su capacidad de travesar el endotelio y su susceptibilidad a la oxidación4). Todo ello, daría como resultado el exceso de ácidos grasos libres circulantes que abocan a un aumento en la producción de triglicéridos en el hígado6.
Además de la disminución de la sensibilidad a la insulina y las alteraciones arriba citadas, a este síndrome se le ha añadido, desde su descripción, una constelación de anormalidades entre las que se incluyen una mayor propensión a la enfermedad trombótica, irregularidades menstruales (hiperandrogenismo funcional ovárico), inflamación crónica de bajo grado y alteraciones en el metabolismo del hierro, entre muchas otras, contribuyendo en mayor o menor medida al desarrollo de enfermedad cardiovascular9.
Alteraciones en el metabolismo del hierro
El hierro interferiría con la producción hepática de glucosa al inhibir parcialmente el efecto de la insulina sobre esta producción, entre otros motivos, abocando al desarrollo de hígado graso, otro de los componentes del síndrome metabólico10. Además de los efectos moduladores sobre los tejidos sensibles a la insulina, el hierro también afectaría a las propias células β productoras de insulina. Este efecto se observó inicialmente en pacientes con beta-talasemia tratados con múltiples transfusiones de sangre que les abocaba a sobrecarga corporal de hierro, y en alteraciones genéticas de acúmulo de hierro (hemocromatosis)10. Posteriormente, se ha visto que en todo el espectro de alteraciones del metabolismo del hierro se observan alteraciones del metabolismo hidrocarbonado10.
Estado inflamatorio y protrombótico
La resistencia a la insulina se relaciona con un aumento de la inflamación crónica de bajo grado. Existe una relación bidireccional entre la resistencia a la insulina y esta inflamación crónica: cualquier proceso asociado a inflamación, especialmente si es crónica, se asociará a una disminución en la acción de la insulina. A su vez, se ha objetivado que la resistencia a la insulina se asocia a una mayor inflamación crónica per se. De hecho, la inflamación crónica que acompaña a la obesidad abdominal también parece intervenir activamente en el desarrollo de la resistencia a la insulina2,11. De los factores implicados con mayor evidencia destacan diferentes citoquinas: el factor de necrosis tumoral-α y la interleukina 6, que aboca a una mayor producción de proteína C reactiva, entre otros12.
El estado protrombótico se caracteriza por determinadas alteraciones que, por una parte, disminuyen el proceso fibrinolítico y por otra, favorecen la coagulación. Esta fibrinólisis alterada conlleva un aumento de la enfermedad cardiovascular. El fibrinógeno, reactante de fase aguda semejante a la proteína C reactiva producida por el hígado, aumenta en respuesta a un estado de citocinas elevadas. De este modo, el estado protrombótico y proinflamatorio pueden estar metabólicamente interconectados2,11.
Más recientemente, se ha implicado a la microbiota intestinal (el conjunto de bacterias y otros microorganismos que conviven con nosotros) en el desarrollo de resistencia a la insulina. Este aspecto tiene mucho interés porque se ha visto que la metformina, un fármaco ampliamente utilizado en el tratamiento de la diabetes tipo 2, podría ejercer su acción a través de esta microbiota intestinal, mejorando el metabolismo de la glucosa. Por ejemplo, se ha visto que aumentaría la abundancia relativa de bacterias “protectoras” (bifidobacterium adolescentis) que contribuirían al efecto antidiabético de la metformina13.
CONCLUSIONES
El estudio sistemático de la resistencia a la insulina ha contribuido a caracterizar las alteraciones que se producen en los pacientes con síndrome metabólico y con diabetes tipo 2, y este conocimiento incluso se ha extendido a la población general. De este modo, en el futuro se podrán identificar aquellos sujetos con mayor susceptibilidad y riesgo de desarrollar, en etapas relativamente tempranas de la vida, tanto la diabetes tipo 2 como la enfermedad cardiovascular.
BIBLIOGRAFÍA
- St-Onge MP, Janssen I, Heymsfield SB. Metabolic syndrome in normal-weight Americans: new definition of the metabolically obese, normal-weight individual. Diabetes Care. 2004;27: 2222-8. d
- Yeste D, Carrascosa A. Complicaciones metabólicas de la obesidad infantil [Obesity-related metabolic disorders in childhood and adolescence]. An Pediatr (Barc). 2011;75:135.e1-9.
- Reaven G. Insulin resistance and coronary heart disease in nondiabetic individuals. Arterioscler Thromb Vasc Biol. 2012;32:1754-9.
- Richelsen B, Pedersen SB. Associations between different anthropometric measurements of fatness and metabolic risk parameters in non-obese, healthy, middle-aged men. Int J Obes Relat Metab Disord. 1995;19:169-74.
- Price SA, Gorelik A, Fourlanos S, Colman PG, Wentworth JM. Obesity is associated with retinopathy and macrovascular disease in type 1 diabetes. Obes Res Clin Pract. 2014;8:e178-82. doi: 10.1016/j.orcp.2013.03.007.
- Eckel RH, Grundy SM, Zimmet PZ. The metabolic syndrome. Lancet. 2005;365:1415-28.
- Wang F, Han L, Hu D. Fasting insulin, insulin resistance and risk of hypertension in the general population: A meta-analysis. Clin Chim Acta. 2017;464:57-63.
- Ormazabal V, Nair S, Elfeky O, Aguayo C, Salomon C, Zuñiga FA. Association between insulin resistance and the development of cardiovascular disease. Cardiovasc Diabetol. 2018;17:122.
- Ford ES, Li C, Sattar N. Metabolic syndrome and incident diabetes: current state of the evidence. Diabetes Care. 2008;31:1898-904.
- Fernández-Real JM, Manco M. Effects of iron overload on chronic metabolic diseases. Lancet Diabetes Endocrinol. 2014;2:513-26.
- Ascaso JF, González-Santos P, Hernández Mijares A, Mangas Rojas A, Masana Marín L, Millán Núñez-Cortés J, et al. Diagnóstico de síndrome metabólico. Adecuación de los criterios diagnósticos en nuestro medio. Recomendaciones del foro HDL. Resumen ejecutivo. Rev Clin Esp. 2006; 206: 576-82.
- Fernández-Real JM, Ricart W. Insulin resistance and chronic cardiovascular inflammatory syndrome. Endocr Rev. 2003;24: 278-301.
- Wu H, Esteve E, Tremaroli V, Khan MT, Caesar R, Mannerås-Holm L, et al. Metformin alters the gut microbiome of individuals with treatment-naive type 2 diabetes, contributing to the therapeutic effects of the drug. Nat Med. 2017;23:850-58.