La neuropatía diabética se produce como resultado del daño de los nervios en las personas con diabetes mellitus (DM), habiéndose descartado previamente otros motivos que puede originar también este daño, como son la ingesta alcohólica, compresión de los mismos (por atrapamiento) y el déficit de algunos nutrientes, como la vitamina B12, entre otros.
De todas las complicaciones crónicas, la neuropatía diabética, es una de las menos conocidas. Así, no conocemos bien porqué se produce, porqué unos tienen dolor y otros pérdida de sensibilidad, y cuando se diagnóstica, se suele hacer en fases avanzadas, teniendo, por lo general consecuencias graves. Si además nos referimos en concreto, a la neuropatía diabética dolorosa (NDD), se añade que el control es complejo e insatisfactorio y su abordaje supone un reto para los profesionales implicados. En estas próximas líneas, vamos a analizar en que consiste la NDD, y nos referiremos a la más frecuente, que es la que afecta a los nervios periféricos, describiremos cuanto de frecuente es, porqué se produce, cómo podemos prevenirla, cómo se trata habitualmente y si tenemos otras opciones disponibles.
La neuropatía periférica, es la más común de las neuropatías en la DM. Afecta por término medio al 30% de las personas, si bien puede oscilar entre un 10% si solo tenemos en cuenta si aparecen síntomas, un 30% si consideramos los datos de la exploración física, como la pérdida de sensibilidad y hasta un 50%, si realizamos pruebas como la determinación de la velocidad de conducción de nervios a través de un electroneurograma. También se conoce como polineuropatía distal y simétrica, porque afecta fundamentalmente a los pies, y si es muy grave y con el tiempo, puede afectar también a las manos. Se dice por ello, que tiene una distribución en guante y calcetín. Entre las personas con DM y neuropatía periférica, un 30-50% tienen dolor o NDD, siendo igual de frecuente en la DM tipo 1 y en la DM tipo 2.
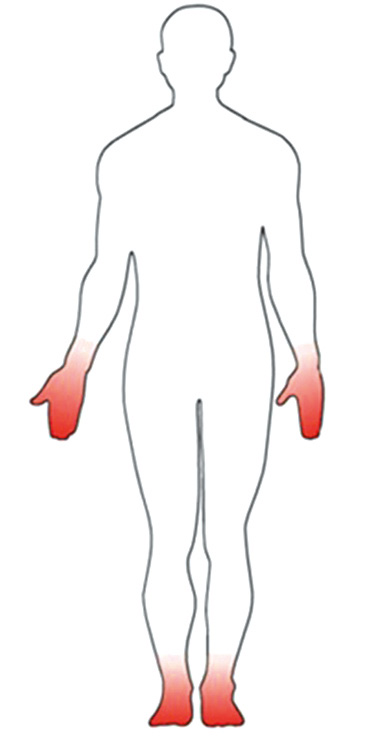
Figura 1. Distribución típica en guante y calcetín.
La NDD suele aparecer tras años de evolución de la enfermedad, por lo general asociado a mal control glucémico y a otras complicaciones, como la retinopatía y la enfermedad renal diabética, siendo la hiperglucemia su principal responsable. Sin embargo, esto es más cierto para los pacientes con DM tipo 1, donde hay un momento más preciso cuando se inicia la hiperglucemia, pero no para la DM tipo 2, donde no es infrecuente que el diagnóstico de la NDD coincida con el de la propia DM. Esto es así, porque años atrás ha podido tener hiperglucemia mantenida y lo desconocía, o porque previamente al diagnóstico ha tenido hiperglucemia muy leve, como la intolerancia hidrocarbonada, que como es sabido es una situación que antecede años atrás a la diabetes y que ya desde ese momento se asocia a mayor riesgo de neuropatía. Este periodo, es lo que se ha venido a llamar prediabetes. También se sabe, que otros factores como la obesidad, la hipertensión, dislipemia, a destacar hipertrigliceridemia y la situación de resistencia a la insulina, desempeñan un papel causante de la neuropatía en general y la NDD en particular.
Seguro que se preguntarán. ¿Cuáles son los síntomas? ¿Cómo les puede cambiar la vida a las personas con NDD? Todos tenemos en mente, que cuando los nervios se dañan, dejan de transmitir adecuadamente sensaciones como son el calor, el frío, la presión, como cuando nos roza un zapato o cuando nos hacemos una herida en los pies y nos avisan que hay un daño, nos duele. Esta sensibilidad nos protege de tener lesiones en los pies y también nos permite andar, sin pensar como hemos de poner los pies en cada paso (lo hacemos a diario de manera inconsciente), sin caernos al suelo. Las personas con NDD, con frecuencia tienen en mayor o menor grado, pérdida de esta sensibilidad, y además síntomas como: dolor, quemazón, pinchazos, calambres de manera espontánea y continua, o bien sienten de una manera intensa y desagradable, pequeños roces o estímulos que no deben ocasionar dolor (alodinia), como puede ser el roce de una sábana, o bien siente dolor ante estímulos que no ocasionan tanta molestia (hiperalgesia). Estos síntomas son más frecuentes por la noche, produciendo insomnio, no se descansa bien y por tanto reducen el sueño reparador. Típicamente, cuando ocurre por las noches, mejoran al andar pisando descalzo el suelo con los pies, que está más frío. Cuando estos dolores se instauran durante días y días, se entiende que reduzcan la calidad de vida, que se asocie con ansiedad y depresión y que sea uno de los motivos, junto con la pérdida de sensibilidad, que produce más discapacidad en las personas con diabetes. Consideremos también que cuando se reducen la sensibilidad de protección, se aumenta el riesgo de lesionarse los pies, apareciendo lo que denominamos pie diabético. A esto hay que añadir que, por lo general, los pacientes con NDD, tienen una forma más grave de neuropatía periférica, suelen tener también neuropatía autonómica (afecta al sistema nervioso autonómico que regula parte del funcionamiento del aparato digestivo, cardiovascular y capacidad de sudoración, entre otros) y son una población de mayor riesgo cardiovascular, con mayores tasas de mortalidad, que la población con DM pero sin esta complicación.
LA NDD SUELE APARECER TRAS AÑOS DE EVOLUCIÓN DE LA ENFERMEDAD, POR LO GENERAL ASOCIADO A MAL CONTROL GLUCÉMICO Y A OTRAS COMPLICACIONES, COMO LA RETINOPATÍA Y LA ENFERMEDAD RENAL DIABÉTICA, SIENDO LA HIPERGLUCEMIA SU PRINCIPAL RESPONSABLE
Los mecanismos que explican por qué se produce la NDD no es bien conocido. Es fácilmente entendible que la hiperglucemia, junto con los otros factores enumerados anteriormente, produzcan daño en las neuronas y en las células de Schwann, que son las que producen la mielina, vaina que envuelven los axones neuronales y que aumentan la velocidad de conducción del impulso nervioso. Este daño sería producido por daño directo de la glucosa en estas células, por fenómenos inflamatorios, daño microvascular y por mecanismos oxidativos intracelulares, ocasionando que las neuronas se mueran y/o dejen de funcionar correctamente, no informando a nuestro cerebro de lo que ocurre en nuestro entorno. Esas fibras nerviosas, cada cual especializada en una sensibilidad distinta, alcanzaría la medula espinal y posteriormente nuestro cerebro (Fig. 2 y 3).
En la actualidad se sabe, que además del daño en los nervios periféricos, existe daño y alteraciones funcionales en las neuronas de la medula espinal y en áreas del cerebro que integran y modulan, la información sensitiva de nuestro cuerpo, como es el tálamo. Es decir que la neuropatía periférica tambien tiene consecuencias en el sistema nervioso central, a nivel medular y del cerebro. Pues bien, algunas personas con neuropatía periférica, desarrollan dolor por un mecanismo maladaptativo. Este se produce por un aumento de la sensibilidad de los receptores para el dolor, nociceptores, a nivel periférico y por aumento de neurotransmisores que facilitan las vías de comunicación del dolor, aún sin estimulo doloroso. Esta información «dolorosa» que llega a la medula espinal y al cerebro, de manera más concreta al tálamo, bombardean esta estructura, aumentando la sensibilidad y se amplifica, percibiendo como dolor, cualquier estimulo, aunque no sea nociceptivo. Las mujeres, algunas etnias como la europea frente a la asiática y determinados patrones genéticos, con más frecuencia presenta dolor, como forma de expresión predominante de la neuropatía en personas con DM.
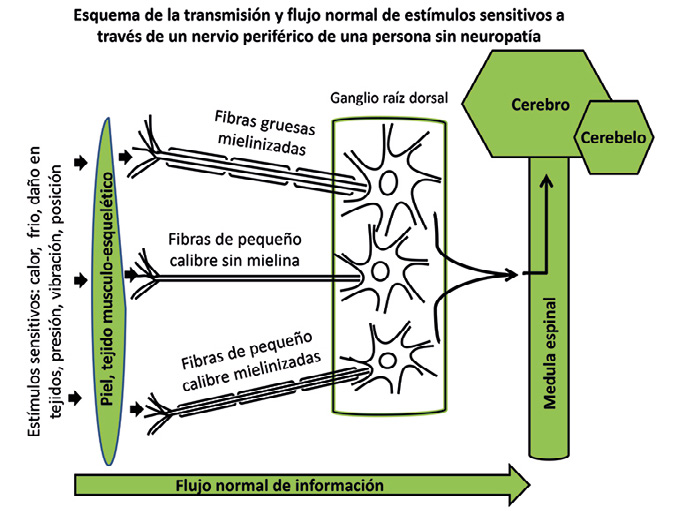
Figura 2. Esquema de la transmisión y flujo normal de estímulos sensitivos a través de un nervio periférico de una persona sin neuropatía
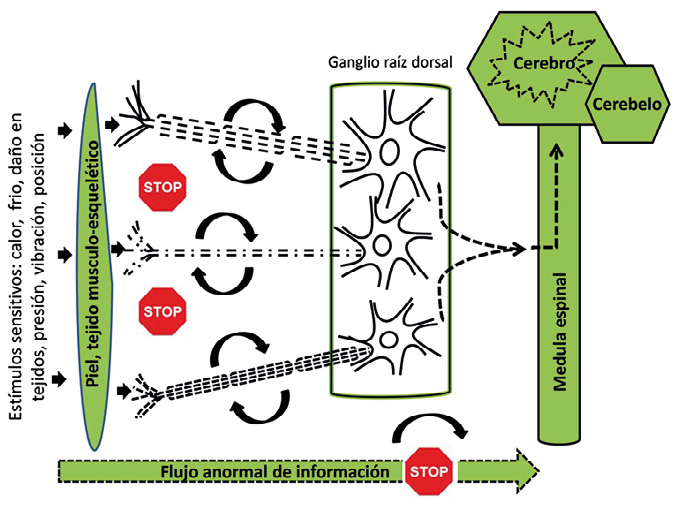
Figura 3. Esquema de la transmisión y flujo de estímulos sensitivos a través de un nervio periférico de una persona con diabetes y neuropatía
EL TIEMPO MEDIO DE DURACIÓN DEL DOLOR PACIENTES CON NDD QUE SE INCLUYEN EN LOS ENSAYOS PARA TESTAR LOS FÁRMACOS, ES DE 3-4 AÑOS SI BIEN SE INCLUYEN PACIENTES CON SÍNTOMAS PERSISTENTES O CRONIFICADOS
Y una vez instaurada la NDD. ¿Es reversible y cuánto es de importante un buen control glucémico? ¿Cuál es su evolución? Poco sabemos de estos aspectos. Parece que en la DM tipo 1 un buen control mejora algunos aspectos de la neuropatía como es la velocidad de conducción nerviosa, sobre todo en fases más iniciales y en lo que se refiere a su prevención, pero en la DM2 los datos no son claros respecto una relación entre la intensificación del control glucémico y menores tasas de neuropatía. Se hipotetiza, que en la DM tipo 2, aspectos como la mejoría de la resistencia a la insulina, que no siempre podemos controlar adecuadamente y que subyace en esta enfermedad, son condicionantes de gran peso en la aparición y progresión de la neuropatía. Un aspecto a considerar en pacientes con mal control glucémico previo, es que la intensificación del control se debería hacer de manera escalonada, dado que una normalización rápida del ambiente glucémico, resultando en muchas hipoglucemias, se han asociado a aumento y progresión de la neuropatía. También se deben reducir la variabilidad glucémica (limites y oscilaciones entre los que se mueven nuestras glucemias capilares y/o glucosa intersticial a lo largo del día), al ser uno de los factores dentro del control glucémico, que más influye en la aparición y progresión de la neuropatía diabética.
Respecto el tiempo que dura los síntomas no hay mucha información, pero los pocos estudios que lo analizan, demuestran, que 2/3 de los pacientes en un plazo de 24-36 meses los síntomas se reducen, pero no desaparecen y que pocos desaparecían del todo. El tiempo medio de duración del dolor pacientes con NDD que se incluyen en los ensayos para testar los fármacos, es de 3-4 años, si bien se incluyen pacientes con síntomas persistentes o cronificados, pero nos da una idea de lo que dura el proceso una vez instaurado. Conocer estos datos, son importantes tanto para el paciente que sufre la NDD, como para el médico que lo trata, para saber a que nos enfrentamos y que se trata de un problema que con frecuencia se cronifica. Un aspecto práctico en el abordaje de estos pacientes es la reversibilidad de la pérdida de funcionalidad neuronal de los nervios/áreas afectadas en pacientes con neuropatía diabética, existiendo unanimidad, que cuando la neuropatía es grave, como la que suele haber en pacientes con NDD, la pérdida de fibras nerviosas y la sensibilidad asociada, es en gran parte, irreversible.
El abordaje terapéutico de estos pacientes, se fundamenta en:
- Modificación del estilo de vida, mediante dieta y ejercicio, así como con el control del exceso de peso. Con estas estrategias, no solo mejora control glucémico, sino que en el caso de las personas con DM tipo 2 mejora el estado de resistencia a la insulina, siendo clave para la prevención y para evitar la progresión de la neuropatía.
- Adecuar grado de control glucémico a la situación clínica del paciente. Aunque una mejora en el control glucémico es positiva para la mayoría de los pacientes con DM, hay que considerar edad, estado cardiovascular, grado de fragilidad o vulnerabilidad antes situaciones de estrés y enfermedad, para no intensificar tanto el control glucémico, dado que el efecto neto sobre su esperanza y calidad de vida podría ser negativo cuando el control glucémico es muy estricto y aumentan las hipoglucemias.
- Control de factores de riesgo cardiovascular como control de lípidos, presión arterial y evitar tabaco. Esto tiene doble importancia, al ser factores de riesgo para la aparición de neuropatía y para reducir el riesgo de una población con DM de alto riesgo cardiovascular como es el que tienen los pacientes con NDD.
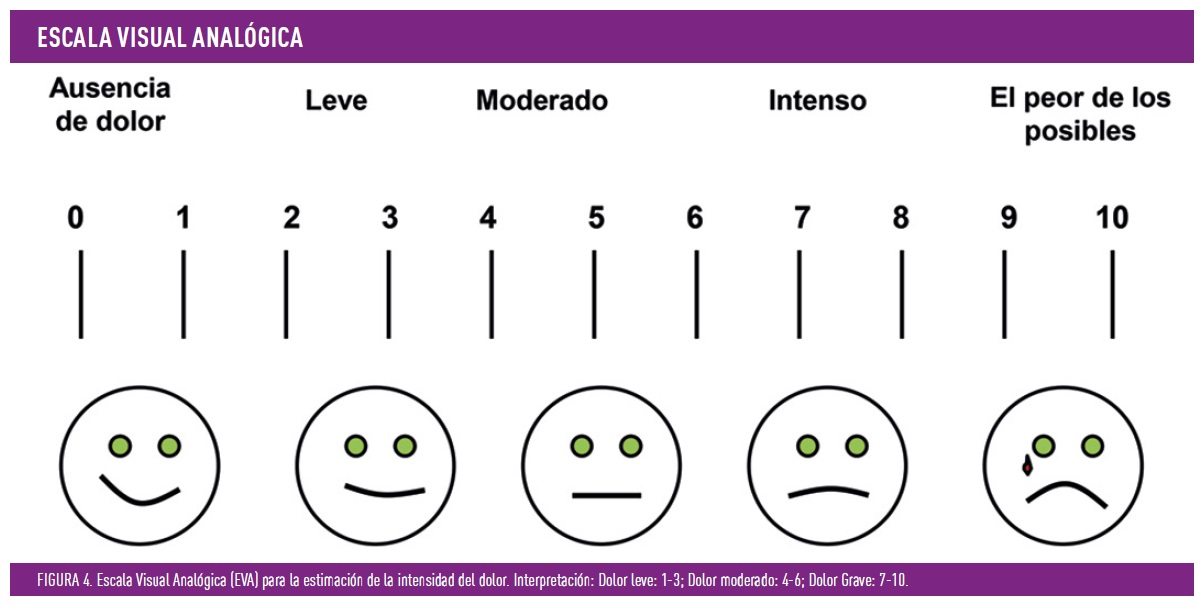
- Tratamiento sintomático del dolor. Este aspecto es crucial, porque muchos pacientes son reacios a usar tratamientos crónicos y una mejoría en su escala de dolor (es útil su cuantificación inicial, figura 4), consigue mejoría del sueño, permitiendo reducir la intensidad del dolor, con sus consecuencias, una mejora en su calidad de vida y quizá en un mejor control glucémico. Es bien sabido por los pacientes con diabetes que una noche con «mal sueño» es igual a un control glucémico malo al día siguiente. También posibilita frenar el circulo vicioso de, más dolor, más «bombardeo» en zona talámica, reduciendo la amplificación de la señal y la intensificación del dolor en los días siguientes. Los fármacos que más se usan en la práctica diaria son: antidepresivos tricíclicos, los inhibidores de la recaptación de serotonina y noradrenalina, como es la duloxetina, y los ligandos de los canales del calcio alfa-2-delta, como son la gabapentina y la pregabalina. Existen más, pero no son ni primera ni segunda línea. Por lo general, fármacos como el metamizol, paracetamol y opiáceos como el tramadol, no son muy útiles, sobre todo usados de manera aislada. Todos estos fármacos se emplean muchas veces asociados entre ellos, para reducir efectos secundarios. Es importante hacer saber al paciente que no modifican el curso de la enfermedad, pero si permite tener una mejor calidad de vida. Todos funcionan interactuando con las vías de conducción del dolor a nivel central.
El problema de estos fármacos, es que no consiguen un buen control en muchos pacientes, por lo que en general, nuestros objetivos deben ser mejorar al máximo la calidad de sueño y reducir escala del dolor, aunque no desaparezca del todo. La mitad de los pacientes no consiguen reducciones superiores a un 50% en la escala de intensidad del dolor y por término medio la reducción del dolor suele ser del 30%. En parte, esto se debe a que los efectos secundarios limitan usar dosis plenas y no pocas veces se tiene que interrumpir el tratamiento y quizá a la falta de adherencia de los pacientes en la toma de los mismos.
¿Y que hacemos con el dolor refractario o los pacientes que no toleran los medicamentos orales? Muchos de los pacientes que toman estos medicamentos de manera crónica, al menos 3 meses, no consiguen reducir la intensidad del dolor de la escala de moderado, es decir se mantiene en una puntuación 4-6 de la escala EVA y no pocos se mantienen es la escala de grave, repercutiendo en su vida diaria de manera negativa. Aunque existen varias opciones, he destacado dos por su interés práctico y que pueden despertar el interés en los interesados en esta complicación.
- Uso de capsaicina en parches al 8%, se ha visto que aplicado durante 30 minutos en los pies cada 3 meses, en la zona donde se siente el dolor, reduce la intensidad del mismo con igualdad de potencia que los medicamentos orales y sin los efectos adversos de estos. La capsaicina reduce la transmisión de señales de nocicepción, al descargar el neurotransmisor, sustancia P, de las terminaciones nerviosas de las fibras no mielinizadas o tipo C, por lo tanto, actuan a nivel periférico. La limitación es su precio, reducción progresiva de efectos a partir del mes de su aplicación y que no siempre la zona donde los pacientes sienten el dolor es pequeña y no está limitada a la superficie del parche. En Europa está comercializado en parches de 14×20 cm, y en España está financiado, si bien la aportación es la habitual. El nombre comercial es Qutenza 179 mg parche cutáneo®, y debe ser aplicado por un profesional sanitario, delimitando previamente la zona de la piel a tratar.
- Uso de neuroestimuladores de la medula espinal. Esto consiste en la implantación de un dispositivo con uno o varios electrodos epidurales en las columnas posteriores de la médula espinal al nivel de los dermatomas (zonas donde sabemos está ubicado el nervio que transmite la sensibilidad dolorosa) en los que se quiere conseguir el efecto analgésico. Los actuales emiten una descarga eléctrica, imperceptible para el ser humano, de alta frecuencia, 10 kHz, bloqueando que las señales dolorosas alcancen nuestro sistema nervioso central, reduciendo o eliminando el dolor.
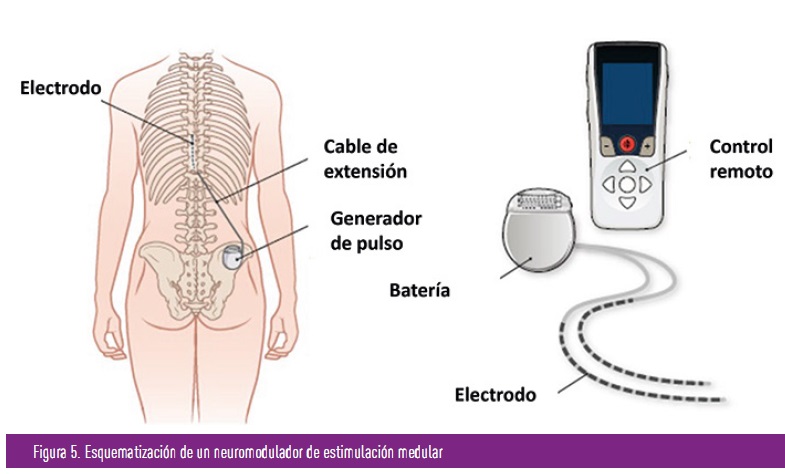
Es una técnica que se lleva empleando y mejorando desde hace más de 50 años en las Unidades del Dolor, para tratar dolores de muy diverso tipo (dolores radiculares originados en la columna vertebral, dolor tras padecer un herpes zoster, etc.), si bien en la NDD se ha empleado poco hasta ahora. En la actualidad existen ensayos que avalan su uso, y que han demostrado que en una población amplia de personas con NDD, y tras empleo de fármacos para su control, pero que persiste el dolor en intensidad moderado-grave (dolores refractarios), consigue reducciones de un más de un 50% del dolor, en un 80% de los mismos frente a los que no usaban estos dispositivos. Esto ha permitido, que algunas agencias reguladoras como la FDA, haya autorizado y ampliado su uso en estas situaciones, como es la NDD refractaría.
Esta modalidad terapéutica permite mejoría del dolor, con más intensidad y en mayor número de personas, que con fármacos o tratamientos locales, reduciendo así la medicación, efectos adversos y mejorando notablemente la calidad de vida de las personas. Es una terapéutica que se ha demostrado coste-efectiva. La FDA recientemente, en enero de 2022, aprobó dos neuroestimuladores, el IntellisTM y VantaTM de la compañía Medtronic. El primero es recargable y puede proporcionar dosis más altas de estimulación eléctrica, mientras que el segundo no se recarga y puede proporcionar pulsos eléctricos más débiles durante años sin necesidad de cargarlo. Son dispositivos, compatibles con la mayoría de dispositivos electrónicos y de pruebas radiológicas como una resonancia, y que conocen bien la mayoría de las Unidades del Dolor de nuestros centros hospitalarios del SNS y que se emplean siguiendo protocolos de actuación ante el dolor refractario, y en este caso por NDD. Son por tanto una buena alternativa para estas situaciones.
En resumen,
La neuropatía diabética dolorosa es una complicación de la diabetes por daño, en la mayoría de las veces, de los nervios periféricos, si bien hoy sabemos que también hay alteraciones en la medula espinal y en el cerebro. Es un dolor que reduce la calidad y cantidad de sueño, interfiriendo en la calidad de vida de las personas con diabetes. Se produce por exposición durante años a la hiperglucemia, con otros factores asociados, sobre todo en personas con DM tipo 2, como son la obesidad, resistencia a la insulina y los factores de riesgo cardiovascular.
Una vez que aparece, suele haber daño irreversible y reducción de la sensibilidad protectora, siendo por tanto su diagnóstico tardío. La clave, por tanto, es su prevención y una vez que aparezca debemos intensificar el grado de control de todos los factores implicados, adecuando el grado de control glucémico en la persona con DM. El tratamiento de esta patología es sintomático. El control del dolor, en muchas ocasiones insatisfactorio, es clave para mejorar la calidad de vida de estas personas, teniendo a disposición fármacos, que se van emplear durante meses e incluso años. Para aquellos, en los que el control no sea adecuado o imposible por los efectos secundarios de los medicamentos, hay opciones disponibles, que bien empleadas, pueden mejorar notablemente sus vidas.
Referencias
- Anuncio de aprobación por FDA de neuromodular para el tratamiento de la Neuropatía diabética dolorosa. [Consultado el 6 de marzo de 2022]. Disponible en: https://news.medtronic.com/2022-01-24-Medtronic-announces-FDA-approval-of-spinal-cord-stimulation-therapy-for-treating-chronic-pain-resulting-from-diabetic-peripheral-neuropathy
- Finnerup NB, Attal N, Haroutounian S, McNicol E, Baron R, Dworkin RH et al. Pharmacotherapy for neuropathic pain in adults: a systematic review and meta-analysis. Lancet Neurol. 2015 Feb;14(2):162-73. https://doi.org/10.1016/S1474-4422(14)70251-0
- Peltier A, Goutman SA, Callaghan BC. Painful diabetic neuropathy. BMJ. 2014 May 6;348:g1799. https://doi.org/10.1136/bmj.g1799. Erratum in: BMJ. 2014;348:g3440.
- Rosenberger DC, Blechschmidt V, Timmerman H, Wolff A, Treede RD. Challenges of neuropathic pain: focus on diabetic neuropathy. J Neural Transm (Vienna). 2020 Apr;127(4):589-624. https://doi.org/10.1007/s00702-020-02145-7
- Sloan G, Selvarajah D, Tesfaye S. Pathogenesis, diagnosis and clinical management of diabetic sensorimotor peripheral neuropathy. Nat Rev Endocrinol. 2021 Jul;17(7):400-420. https://doi.org/10.1038/s41574-021-00496-z







