La diabetes mellitus tipo 2 (DM2) es una enfermedad epidémica que afecta al 12% de la población de mediana edad, y cuya incidencia continúa aumentando de manera rápida impulsada por un entorno claramente obesogénico. Las abrumadoras consecuencias para la salud ocasionadas por la DM2 afectan a los vasos de pequeño y gran tamaño, conduciendo al desarrollo de nefropatía, retinopatía y polineuropatía, así como a la enfermedad macrovascular potencialmente mortal. En consecuencia, la DM2 se ha convertido en una de las principales amenazas para la salud pública, problema que se magnifica si consideramos que la mitad de los pacientes con DM2 aún desconocen que conviven con la enfermedad.
El pulmón no se considera un órgano diana “clásico” de las complicaciones de la DM2. Sin embargo, los mismos mecanismos que provocan las complicaciones en otros sistemas también afectan a la función pulmonar (1). Y es importante señalar que la disminución mantenida en valores de función pulmonar, como el volumen espiratorio forzado en un segundo (FEV1) y la capacidad vital forzada (CVF) son predictores independientes tanto de mortalidad por todas las causas como de mortalidad cardiovascular en los pacientes con DM2 (2).
Función pulmonar en los pacientes con DM2
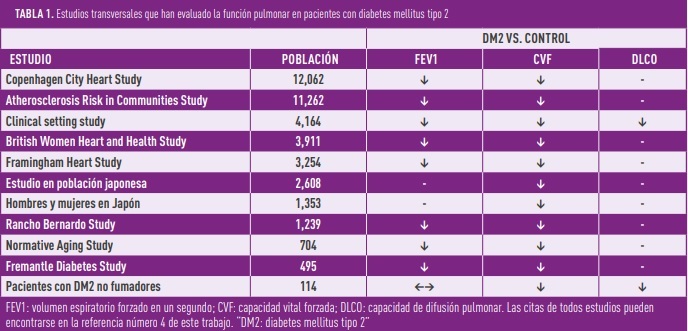
Los estudios transversales muestran, de manera repetida, que los sujetos adultos con DM2 tienen unos valores de FEV1 y CVF entre un 8 y un 10% más bajos que la población general sin DM2 (Tabla 1) (2). Estos estudios han considerado factores de confusión como la edad, el sexo, la obesidad, el tabaquismo y la duración de la diabetes. También se observa cómo los valores más elevados de glucemia en ayunas y de hemoglobina glicosilada se correlacionan de manera inversa con los valores de FEV1 y CVF (1, 2). En otras palabras, si eres un paciente con DM2, cuanto peor sea tu control metabólico más reducida va a estar tu función pulmonar. Por último, aunque la capacidad de difusión pulmonar (DLCO) se ha evaluado en menos estudios, no hay duda de que la DM2 también tiene un impacto negativo sobre ella. Este efecto se hace más patente durante el ejercicio físico y en pacientes que combinan diabetes y obesidad, y se estima que la reducción se sitúa alrededor de un 10-25% en comparación con la población general (3).
También se ha comunicado que los pacientes con diabetes mellitus tipo 1 (DM1) muestran valores espirométricos más bajos en comparación con el grupo control sin diabetes, junto con mayor prevalencia de valores de FEV1 <80% y de pacientes con un patrón ventilatorio restrictivo (4).
Estudios prospectivos y evolución de la función pulmonar en la DM2
Algunos estudios han evaluado cómo evoluciona la función pulmonar con el paso de los años en los pacientes con DM2. Así, por ejemplo, en el ARIC Study y en el Fremantle Diabetes Study, tras 3 y 7 años de seguimiento respectivamente, se observó una mayor disminución de la CVF en los sujetos con DM2 que en la población general. En ambos estudios, tanto la duración de la diabetes y como el control metabólico se asociaron de manera directa con un mayor deterioro de la función pulmonar durante el tiempo de seguimiento. Los datos obtenidos en estos estudios permiten estimar que la disfunción pulmonar se inicia unos 3 años antes del diagnóstico de la diabetes, haciéndonos pensar que ambos procesos comparten mecanismos etiopatogénicos como la resistencia a la insulina o la inflamación crónica de bajo grado. Sin embargo, encontramos también estudios longitudinales, como el Normative Aging Study y el Copenhagen City Heart Study, que no muestran diferencias en la trayectoria de la función pulmonar entre los participantes con y sin DM2. En conjunto, puede afirmarse que en todos los estudios transversales y en gran parte de los longitudinales los pacientes con DM2 presentan valores más bajos de FEV1, CVF y DLCO que los participantes sin diabetes (4).
Principales mecanismos por los que la DM2 afecta a la función pulmonar
Los mecanismos etiopatogénicos por los que la DM2 ejerce su efecto deletéreo sobre la función pulmonar son diversos, e incluyen a la resistencia a la insulina, la inflamación crónica de bajo grado, la disminución de la fuerza muscular, la glicosilación no enzimática de las proteínas del parénquima pulmonar, la microangiopatía y la neuropatía autonómica (2). Debe tenerse en cuenta que cada uno de ellos explicaría sólo una parte del cuadro y que pueden manifestarse simultáneamente en un mismo paciente.
Es bien sabido que la resistencia a la insulina es el principal mecanismo responsable del desarrollo de la DM2. Y de forma similar, parece ser crucial en el inicio de anomalías pulmonares en pacientes con DM2, apuntando al pulmón como un nuevo componente del síndrome metabólico. Así, en mujeres con obesidad grave sin diabetes, la RI mostró ser un determinante independiente de la mayor resistencia de la vía aérea, contribuyendo a la variación del FEV1, el flujo espiratorio máximo (FEF25-75) y la CVF (5).
La inflamación sistémica crónica de bajo grado es otro factor estrechamente relacionado con el desarrollo de la DM2. Y también tiene un efecto negativo sobre el pulmón, apareciendo como una buena justificación biológica para explicar la mayor incidencia de síntomas respiratorios similares al asma en la población adulta. En este sentido, cuando inhibimos la inflamación, ya sea mediante el uso de fármacos en humanos o en un modelo animal, se reduce significativamente la infiltración de células inflamatorias, disminuye la muerte celular y se aumenta la estabilidad de las membranas a nivel pulmonar. De manera similar, en pacientes con DM2 sin enfermedad pulmonar, los niveles elevados de marcadores inflamatorios se asocian con deterioro de la función pulmonar cuando la HbA1c se encuentra por encima de 7,0% (6). Estos hallazgos sugieren que las vías inflamatorias relacionadas con la DM2 son un factor etiopatogénico precozmente involucrado en el desarrollo de la disfunción pulmonar.
El pulmón acoge al principal lecho vascular en el ser humano, por lo que el daño de la microcirculación pulmonar es un reflejo del grado de microangiopatía sistémica y, por lo tanto, también se relaciona con el control glucémico. Como manifestación de esta microangiopatía pulmonar se han reportado disminuciones en la DLCO, que se correlacionan con el grado de retinopatía y de nefropatía. Sin embargo, la gran densidad de pequeños vasos en el pulmón permite compensar cualquier pérdida inicial en la función del parénquima pulmonar, pudiendo pasar desapercibida y solo ser diagnosticada cuando la afectación es ya muy importante.
Tanto la resistencia a la insulina como la DM2 se asocian con una menor fuerza muscular, lo que se traduce a nivel de la célula muscular, el miocito en un mayor depósito de lípidos, la disminución de la concentración de mitocondrias y la aparición de atrofia muscular. Estos cambios favorecen la disminución de la fuerza muscular observada en pacientes con DM2 y provoca un efecto negativo sobre la función contráctil de la musculatura torácica. Así, en el Berlin Aging Study II, la masa muscular junto con la obesidad abdominal fueron los principales factores implicados en la capacidad pulmonar de los sujetos con DM2 y síndrome metabólico.
La neuropatía autonómica que desarrollan los pacientes con DM2 también se ha asociado con una mayor prevalencia de disfunción pulmonar. Así, los pacientes con DM2 y neuropatía muestran una correlación negativa entre la fuerza muscular en reposo y la frecuencia cardíaca y la duración de la diabetes. De manera similar, en adolescentes con diabetes tipo 1, la presencia de neuropatía autonómica se asoció con el deterioro de las pruebas de función pulmonar, principalmente con valores significativamente más bajos de FEV1, CVF y velocidad de flujo espiratorio (7).
No todo acaba con los mecanismos etiopatogénicos “clásicos”
Existen otros 3 mecanismos etiopatogénicos implicados en el impacto deletéreo de la DM2 en la función pulmonar que merecen ser comentados: la resistencia a la leptina, la glicosilación no enzimática de determinadas proteínas y los defectos en la capa de surfactante bronquiolar (2).
Así, la resistencia a la acción de la leptina es un factor clave en la aparición de un patrón pulmonar restrictivo, ya que en condiciones normales es capaz de evitar la broncoconstricción del árbol bronquial favoreciendo el aumento fisiológico de su diámetro. Por su parte, el tejido conectivo pulmonar es rico en proteínas como el colágeno, la elastina y la fibronectina, que en la hiperglucemia crónica pueden verse sometidas a un proceso de glicosilación no enzimática, volviéndose más rígidas y favoreciendo el desarrollo de un patrón respiratorio más restrictivo. Por último, en la DM2 se han objetivado defectos en la capa de surfactante bronquiolar, que en condiciones normales participa en el mantenimiento de la estabilidad y el diámetro de la vía respiratoria y en la prevención del colapso pulmonar, contribuyendo al deterioro de la función pulmonar. En este sentido, quizás lo más interesante sea saber que en el pulmón existen receptores para el péptido similar al glucagón tipo 1 (GLP-1), cuya activación estimula la síntesis de surfactante pulmonar.
Cambios histológicos en el pulmón de los pacientes con DM2
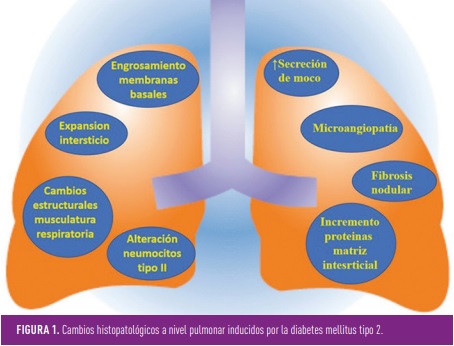
Los cambios histológicos a nivel pulmonar en los pacientes con DM2 son homogéneos en todo el parénquima e incluyen engrosamiento del epitelio alveolar y de la lámina basal de los capilares pulmonares, la disminución del espacio alveolar, la presencia de un mayor grado de fibrosis, de enfisema centrolobulillar y de microangiopatía pulmonar, así como variaciones en la secreción de moco (2). Es importante destacar que existe una correlación entre los hallazgos en el pulmón y el grosor de la lámina basal en el túbulo renal, lo que apoya la existencia de un mecanismo patológico similar que afecta a ambos órganos.
¿Cómo tratar al paciente con DM2 y disfunción pulmonar?
Todo lo comentado hasta este momento plantea la pregunta crítica de si la optimización del control glucémico puede mejorar de manera significativa la función pulmonar de los pacientes con DM2. En un modelo animal, Ramadan et al. evidenció la contribución de la resistencia a la insulina en el desarrollo de episodios de apneas durante el sueño, y cómo el tratamiento con metformina, un fármaco utilizado para aumentar la sensibilidad a la insulina, no solo previene, sino que también resuelve los episodios de apnea (8). Recientemente también se ha comunicado cómo en humanos, optimizar el control glucémico durante 3 meses mejora significativamente los valores de FEV1 y CVF, de manera independiente a la pérdida de peso (9).
Del mismo modo, también se ha evaluado el posible efecto beneficioso en la función pulmonar del uso de los agonistas del receptor de GLP-1. Así, la administración durante 7 semanas de liraglutida (2 semanas de titulación más 5 semanas a 1,8 mg diarios) ejerce un impacto positivo sobre la CVF en comparación con la administración de placebo subcutáneo (10). Es importante señalar que, en este estudio, la duración del tratamiento con liraglutida fue intencionalmente corta con el objetivo de minimizar la pérdida de peso como posible factor de confusión. Más interesante aún, la dosis de insulina basal (U/kg/día) en pacientes con diabetes tipo 1 mostró una correlación negativa con los valores de FEV1 y CVF, lo que podría relacionarse con la presencia de receptores de insulina en los neumocitos tipo II y la coexistencia de resistencia a la insulina (4).
Conclusiones y expectativas de futuro
La información expuesta a lo largo de esta breve revisión sobre el impacto negativo de la DM2 en el parénquima y la función pulmonar debe obligarnos a redefinir la relación entre endocrinólogos, neumólogos y médicos de atención primaria en la práctica clínica habitual. Toda la evidencia mostrada apunta al pulmón como un nuevo órgano diana en las complicaciones de la DM2, y nos lleva a considerar a los pacientes con DM2 como un grupo vulnerable para presentar algún grado de disfunción pulmonar. Además, es importante remarcar que no debemos querer clasificar a esta disfunción únicamente como restrictiva u obstructiva, pues cada mecanismo etiopatogénico ejerce un impacto negativo peculiar sobre la función pulmonar.
Por tanto, discernir cómo identificar a los pacientes con DM2 que presentan un mayor riesgo de enfermedad pulmonar y cuál es la mejor opción de tratamiento debe ser, sin duda, uno de los pilares en los que se basen las futuras investigaciones y las acciones dirigidas a mejorar la salud y la calidad de vida de las personas con DM2.
REFERENCIAS
- van den Borst B, Gosker HR, Zeegers MP, Schols AMWJ. Pulmonary function in diabetes. A metaanalysis. Chest. 2010; 138: 393-406.
- Lecube A, Simó R, Pallayova M, Punjabi NM, López-Cano C, Turino C, et al. Pulmonary Function and Sleep Breathing: Two New Targets for Type 2 Diabetes Care. Endocr Rev. 2017; 38: 550-73.
- Klein OL, Kalhan R, Williams MV, Tipping M, Lee J, Peng J, Smith LJ. Lung spirometry parameters and diffusion capacity are decreased in patients with Type 2 diabetes. Diabet Med 2012; 29: 212–9.
- Sánchez E, Mizab C, Sauret A, Barbé F, Martí R, López-Cano C,et al. Effect of Subcutaneous Insulin on Spirometric Maneuvers in Patients with Type 1 Diabetes: A Case-Control Study. J Clin Med. 2020;9:1249.
- Lecube A, Sampol G, Muñoz X, Lloberes P, Hernández C, Simó R. Insulin resistance is related to impaired lung function in morbidly obese women: a case-control study. Diabetes Metab Res Rev 2010; 26: 639-45.
- Dennis RJ, Maldonado D, Rojas MX, Aschner P, Rondón M, Charry L, Casas A. Inadequate glucose control in type 2 diabetes is associated with impaired lung function and systemic inflammation: a cross-sectional study. BMC Pulm Med. 2010; 10: 38.
- Ďurdík P, Vojtková J, Michnová Z, Turčan T, Šujanská A, Kuchta M, Čiljaková M. Pulmonary function tests in type 1 diabetes adolescents with diabetic cardiovascular autonomic neuropathy. J Diabetes Complications. 2016; 30: 79-84.
- Ramadan W, Dewasmes G, Petitjean M, Wiernsperger N, Delanaud S, Geloen A, Libert JP. Sleep apnea is induced by a high-fat diet and reversed and prevented by metformin in non-obese rats. Obesity (Silver Spring) 2007; 15: 1409-1418.
- Gutiérrez-Carrasquilla L, Sánchez E, Barbé F, Dalmases M, López-Cano C, Hernández M, et al. Effect of Glucose Improvement on Spirometric Maneuvers in Patients With Type 2 Diabetes: The Sweet Breath Study. Diabetes Care. 2019; 42: 617-24.
- López-Cano C, Ciudin A, Sánchez E, Tinahones FJ, Barbé F, Dalmases M, et al. Liraglutide Improves Forced Vital Capacity in Individuals With Type 2 Diabetes: Data From the Randomized Crossover LIRALUNG Study. Diabetes. 2022; 71: 315-20.







