La epilepsia es 4-6 veces más prevalente en los pacientes con diabetes mellitus tipo 1 (DM1) que en la población general y los pacientes con epilepsia tienen 4 veces más prevalencia de DM que la población general (1). Los pacientes con DM1 puede presentar crisis epilépticas de causa metabólica como la hipoglucemia y la hiperglucemia no cetósica (NKH). La etiología autoinmune es una causa menos conocida y es en la que nos centraremos en este artículo.
EPILEPSIAS AUTOINMUNES
Cada vez es más reconocida la etiología autoinmune como causa de epilepsia de debut agudo y también de epilepsias crónicas.
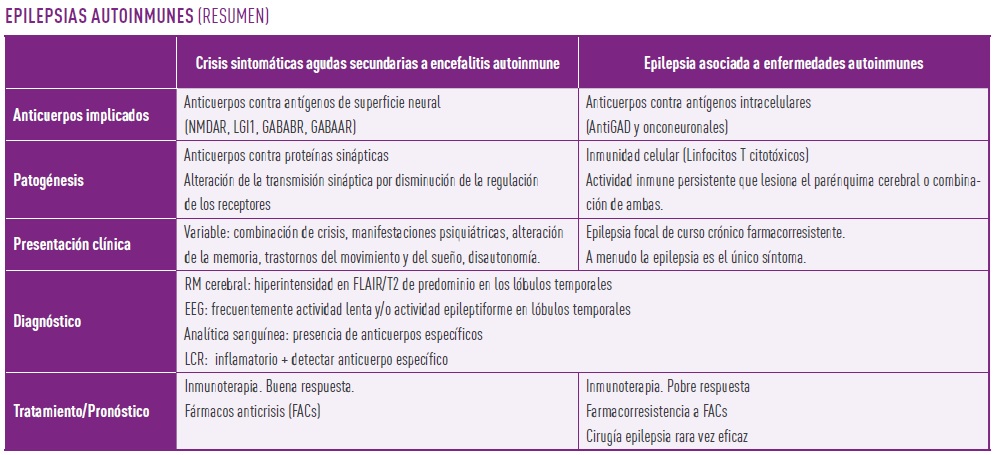
Las crisis epilépticas de etiología autoinmune se clasifican desde 2020 en crisis sintomáticas agudas secundarias a encefalitis autoinmune (los pacientes presentan crisis durante la fase aguda de la enfermedad, pero la mayoría de ellos no desarrollan epilepsia posterior) y epilepsia asociada a enfermedad autoinmune (los pacientes presentan epilepsia de forma crónica) (2).
Los anticuerpos asociados a la epilepsia autoinmune se dividen en (2):
- Anticuerpos contra superficie neuronal y las proteínas sinápticas (predominantemente mediados por inmunidad B). Generalmente producen crisis sintomáticas agudas y, con menor frecuencia, epilepsia autoinmune.
- Anticuerpos contra antígenos intracelulares (predominantemente mediados por inmunidad T). Pueden producir epilepsia autoinmune como en el caso de los anticuerpos ácido glutámico descarboxilasa isoforma 65 (GAD65), enzima que participa en la síntesis del neurotransmisor inhibidor GABA a partir del glutamato. Estas epilepsias son más refractarias y tiene un peor pronóstico. Aunque muchos de estos anticuerpos se asocian a cáncer, la etiología paraneoplásica en epilepsia mediada por GAD65 es extremadamente rara.
GAD 65 ES RESPONSABLE DE LA SÍNTESIS DE GABA, EL PRINCIPAL NEUROTRANSMISOR INHIBITORIO DEL SNC
DENOMINADOR COMÚN: ANTICUERPOS ANTIGAD 65
Los anticuerpos del ácido glutámico descarboxilasa isoforma 65 (GAD65) producen enfermedades autoinmunes del sistema nervioso central (SNC) y más comúnmente, enfermedades autoinmunes no neurológicas siendo la DM1, enfermedad tiroidea autoinmune y la anemia perniciosa las más frecuentemente asociadas. Aproximadamente el 70% de los pacientes con afectación neurológica por GAD65 presenta uno o más de estos trastornos.
Los Ac antiGAD65 reflejan la etiología autoinmune de DM1 y se pueden detectar en > 80% de los pacientes (1)(4), aunque solo el 0,8% tiene anti-GAD > 2000 U/mL a diferencia de los pacientes con enfermedades neurológicas autoinmunes mediadas por estos anticuerpos, en las que los títulos son elevados.
Hay dos isoformas de la descarboxilasa de ácido glutámico: GAD 65 y GAD67. GAD 65 es responsable de la síntesis de GABA, el principal neurotransmisor inhibitorio del SNC. Se encuentra predominantemente en el SNC inhibitorio (GABAérgico) y en los islotes de las células β pancreáticas (3), lo que explica la asociación entre la DM1 y las afecciones del SNC.
Es por ello que los anticuerpos contra GAD65 pueden asociarse con un amplio espectro de síndromes neurológicos, como la ataxia cerebelosa, el síndrome de la persona rígida, la encefalitis límbica y la epilepsia del lóbulo temporal.
GAD65 EN LA EPILEPSIA AUTOINMUNE
Existen dos escenarios clínicos predominantes descritos en la epilepsia autoinmune mediada por GAD65 (2) (3).
- Encefalitis autoinmune: debut agudo/subagudo de crisis aisladas (incluido el New Onset Status Epilepticus – NORSE) o acompañadas de diferentes grados de deterioro cognitivo, alteración del estado mental y trastornos psiquiátricos como consecuencia de la inflamación de la región temporal mesial. Existe un alto riesgo de epilepsia posterior y desarrollo de esclerosis hipocampal como secuela frecuente.
- Epilepsia asociada a enfermedad autoinmune: epilepsia crónica de curso indolente, generalmente farmacorresistente, sin hallazgos inflamatorios en resonancia magnética.
La detección de Ac antiGAD65 se da en el 17% de las encefalitis límbicas, 1.7% – 12.5 % de las epilepsias focales de debut en el adulto de etiología indeterminada (la epilepsia es el principal y en ocasiones único síntoma) y en torno al 6% de las epilepsias refractarias de la infancia (3).
Las crisis son predominantemente focales de origen temporal, frecuentes y resistentes al tratamiento. Es más habitual entre la segunda y tercera década de la vida, tiene mayor prevalencia en mujeres (70-80%) y se asocia a otras enfermedades autoinmunes.
DADO QUE SE TRATA DE UNA ENFERMEDAD AUTOINMUNE, PARA SU TRATAMIENTO, ES NECESARIO DISMINUIR LAS DEFENSAS PARA CONTROLAR EL ATAQUE AL SISTEMA NERVIOSO
CÓMO SE DIAGNOSTICA
Las pruebas fundamentales incluyen:
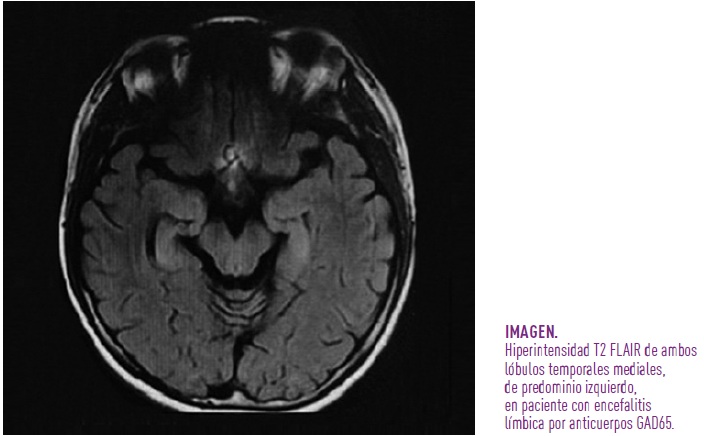
- Resonancia magnética cerebral: puede ser normal o mostrar hiperintensidad en FLAIR/T2 de los lóbulos temporales (imagen 1). En fases tardías, puede observarse atrofia hipocampal (5).
- Electroencefalograma: más del 85% de los pacientes muestran actividad lenta y/o descargas epileptiformes en regiones temporales (5).
- Analítica de sangre: los niveles de anticuerpos GAD65 en suero deben ser elevados (>2000 U/mL). Hay que tener en cuenta que los pacientes con DM1 suelen tener anticuerpos GAD65 en suero a títulos bajos lo que no implica que vayan a desarrollar esta enfermedad. Además, el 2-8% de la población sana presenta títulos bajos de estos anticuerpos.
- Punción lumbar: Es imprescindible analizar una muestra de líquido cefalorraquídeo (LCR). En ocasiones se encuentran datos de inflamación (pleocitosis linfocitaria, presencia de bandas oligoclonales) aunque es frecuente que sea normal (3). Es indispensable para el diagnóstico detectar anticuerpos GAD65 en LCR en cantidad suficiente que demuestre síntesis intratecal (dentro del sistema nervioso central).
CÓMO SE TRATA
El tratamiento se basa en la inmunomodulación. Dado que se trata de una enfermedad autoinmune, para su tratamiento, es necesario disminuir las defensas para controlar el ataque al sistema nervioso. Para ello se usan de primera línea corticoides a dosis altas (con precaución en diabetes ya que puede descompensar el control glucémico), inmunoglobulinas (mejor respuesta en pacientes con síndrome de persona rígida) y plasmaféresis. De segunda línea se suele usar ciclofosfamida, aunque hay casos descritos de pacientes tratados con rituximab, natalizumab o basilximab (7).
Desde el punto de vista sintomático, la epilepsia también debe tratarse con fármacos anticrisis, aunque este tratamiento suele ser insuficiente para su control. Se han descrito casos aislados de cirugía de la epilepsia (resección de lóbulo temporal) con respuestas parciales y a largo plazo insuficientes. También se han utilizado dispositivos de neuromodulación con reducción de más del 50% de las crisis epilépticas (solo 4 casos descritos en la literatura) (8). En general la respuesta al tratamiento es pobre y la epilepsia es de difícil control.
CONCLUSIONES
La epilepsia en el contexto de encefalitis autoinmune por anticuerpos GAD65 tiene mayor incidencia en pacientes con DM1. Sin embargo, la presencia de estos anticuerpos no implica que desarrollen la enfermedad. Es típicamente farmacorresistente y su diagnóstico se basa en títulos elevados de anticuerpos GAD65 en LCR (síntesis intratecal). El tratamiento con inmunomoduladores y fármacos antiepilépticos tiene una respuesta limitada. Identificar la enfermedad a tiempo puede ayudar a optimizar el manejo terapéutico y mejorar la calidad de vida de los pacientes.
BIBLIOGRAFÍA
- Liimatainen et al. GAD65 autoantibody characteristics in patients with co-occurring type 1 diabetes and epilepsy may help identify underlying epilepsy etiologies. Orphanet Journal of Rare Diseases (2018) 13:55 https://doi.org/10.1186/s13023-018-0787-5.
- Justina Valinčiūtė , Neringa Jucevičiūtė , Renata Balnytė , Giedrė Jurkevičienė , Giedrė Gelžinienė GAD65 Antibody-Associated Epilepsy. Medicina (Kaunas). 2023 Jun 12;59(6):1135. doi: 10.3390/medicina59061135.
- Daif, A.; Lukas, R.V.; Issa, N.P.; Javed, A.; VanHaerents, S.; Reder, A.T.; Tao, J.X.; Warnke, P.; Rose, S.; Towle, V.L.; et al. Antiglutamic Acid Decarboxylase 65 (GAD65) Antibody-Associated Epilepsy. Epilepsy Behav. 2018, 80, 331–336. doi: 10.1016/j.yebeh.2018.01.021.
- M Lopez-Sublet 1, H Bihan, G Reach, S Dupont, A Didelot, J-J Mourad, A Krivitzky, R Dhote. Limbic encephalitis and type 1 diabetes with glutamic acid decarboxylase 65 (GAD65) autoimmunity: improvement with high-dose intravenous immunoglobulin therapy. Diabetes Metab. 2012 Jun;38(3):273-5. doi: 10.1016/j.diabet.2012.02.005.
- Kuang Z, Baizabal-Carvallo JF, Alonso-Juarez M, Mofatteh M, Rissardo JP, Pan M, Ye J, Wang Z, Chen Y. The limbic and extra-limbic encephalitis associated with glutamic acid decarboxylase (GAD)-65 antibodies: an observational study. Neurol Sci. 2024 Dec 20. doi: 10.1007/s10072-024-07933-7. Epub ahead of print. PMID: 39704979.
- Ren C, Ren H, Ren X, Zhang W, Li J, Dai L, Guan H, Fang F. Case Report: Autoimmune Encephalitis Associated With Anti-glutamic Acid Decarboxylase Antibodies: A Pediatric Case Series. Front Neurol. 2021 Apr 12;12:641024. doi: 10.3389/fneur.2021.641024. PMID: 33912125; PMCID: PMC8072212.
- Malter MP, Frisch C, Zeitler H, et al. Treatment of inmmune-mediated temporal lobe epilepsy with GAD antibodies. Seizure, 2015; 30:57-63.
- Feyissa AM, Mirro EA; Wabulya A et al. Brain-responsive neurostimulation treatment in patients with GAD65 antibody-associated autoimmune mesial temporal lobe epilepsy. Epilepsia Open 2020; 5: 307-313.