Si bien no se considera al sistema respiratorio como un órgano diana de las complicaciones tardías de la diabetes mellitus tipo 2 (DM2), hay buenas razones para creer que las mismas alteraciones histológicas y fisiológicas que propician la aparición de complicaciones tardías en otras localizaciones como la retina, el riñón o el sistema cardiovascular se reproducen también en al parénquima pulmonar. Pero, además, en los últimos años, crece la evidencia que respalda que la DM2 contribuye también al desarrollo de trastornos respiratorios del sueño[1].
De hecho, los pacientes con DM2 exhiben respuestas ventilatorias atípicas y reducidas a la hipoxia isocápnica, siendo impotentes para responder de manera homeostática al desafío hipóxico [2]. En las siguientes líneas vamos a profundizar en el impacto negativo que la DM2 ejerce sobre la respiración durante el sueño.
¿Qué son los trastornos respiratorios del sueño?
El síndrome de apneas-hipopneas del sueño (SAHS) se caracteriza por episodios repetidos de obstrucción del flujo aéreo, que se traducen en “apnea” (si el cese es completo durante al menos 10 segundos) o “hipopnea” (si el descenso es parcial, pero >50% y asocia una disminución de la saturación de oxígeno ≥4%). Ambos episodios generan una situación de hipoxia que persiste hasta que el esfuerzo inspiratorio provoca un despertar transitorio que restablece la permeabilidad de la vía aérea. Típicamente, este ciclo se repite a lo largo del sueño, en ocasiones cientos de veces. La suma de ambos eventos constituye el índice de apneas-hipopneas (IAH), que permite el diagnóstico del SAHS a partir de 5 eventos por hora (e/h). De forma esporádica el cese del flujo se produce sin el colapso de la vía aérea y sin un esfuerzo respiratorio detectable, catalogándose entonces de episodios de apnea o hipopnea de origen central.
Prevalencia e incidencia del SAHS en pacientes con DM2
La prevalencia del SAHS en población de mediana edad es aproximadamente del 4-9% en hombres y del 1-2% en mujeres, aumentando de forma paralela al incremento del índice de masa corporal (IMC) hasta el 40-70% en sujetos con IMC ≥35 kg/m2 y el 75% en mujeres premenopáusicas candidatas a cirugía bariátrica[3]. Entre los pacientes con DM2, tanto en cohortes clínicas como comunitarias, la prevalencia general es superior al 50%. Además, la incidencia de SAHS también es mayor en los pacientes con diabetes que en la población general.
Así, cuando se analizaron los datos de 151.194 participantes sin SAHS de tres estudios de cohortes prospectivos en Estados Unidos, el hazard ratio para su diagnóstico fue discretamente superior en personas con DM2 en comparación con la población sin diabetes [1,08 (IC del 95%: 1,00 a 1,16)], aumentando sustancialmente en aquellos tratados con insulina [1,43 (IC95%: 1,11 a 1,83)] [4]. Curiosamente, la vulnerabilidad al SAHS en la DM2 es notablemente mayor en el sexo femenino.
Mecanismos patogénicos
Se han sugerido diversos mecanismos patogénicos por los que la DM2 contribuiría a la mayor incidencia de trastornos respiratorios del sueño, como por ejemplo la resistencia a la insulina (RI), la hiperglucemia crónica, la resistencia a la leptina en el control respiratorio central, la crono disrupción, la inflamación sistémica de bajo grado y la neuropatía autonómica [1].
Así, por ejemplo, las mujeres con síndrome de ovario poliquístico, un trastorno asociado con la RI, presentan mayor prevalencia de SAHS y somnolencia diurna, sugiriendo el papel de la RI como mediador de los trastornos del sueño en los seres humanos. De forma similar, en un estudio transversal realizado en 966 sujetos de mediana edad sin enfermedad pulmonar conocida, la presencia de prediabetes se asoció a una mayor prevalencia de SAHS (78,1 vs. 69,9%, p=0,007), un mayor IAH [12,7 (6,1-24,3) vs. 9,5 (4,2-19,6) e/h, p<0,001] a expensas de un mayor incremento en el número de hipopneas [8,4 (4,0-14,9) vs. 6,0 (2,7-12,6) e/h, p<0,001], y menores valores en la saturación nocturna de oxígeno, en el porcentaje de tiempo con saturaciones de oxígeno por debajo del 90% (CT90) y en el índice de desaturación de oxígeno del 4% (p<0,001 para todos) en comparación con los individuos sin prediabetes [5].
Y cuando avanzamos en la gravedad de las alteraciones del metabolismo hidrocarbonado, es importante conocer que la DM2 es un factor de riesgo independiente para presentar tanto un mayor IAH como episodios nocturnos de hipoxia grave, pasando el paciente con diabetes entre 3 y 4 veces más horas de sueño con saturaciones de oxígeno inferiores al 90% que la población sin diabetes[6].
Además, ante un estudio del sueño que nos proporcione un determinado IAH, deberíamos preguntarnos si el paciente que tenemos ante nosotros sufre diabetes. Porque el estudio Sweet Sleep mostró cómo ante un mismo IAH, los pacientes con DM2 presentan una reducción de los eventos de hipopnea y un aumento de los episodios de apnea en comparación con los sujetos sin diabetes, lo que resulta en un patrón de respiración del sueño de mayor gravedad, con episodios respiratorios más profundos y prolongados que ocasionaran una mayor hipoxia tisular (Figura 1)[7]. Este es un hallazgo crucial porque la hipoxemia relacionada con el sueño y su fragmentación conducen a una menor calidad del sueño, con hiperactividad simpática, mayor estrés oxidativo, disfunción endotelial, un perfil lipídico aterogénico, alteración en la regulación de los genes reloj y el aumento de la presión arterial, factores que pueden contribuir al aumento del riesgo cardiovascular detectado en la DM2[1,2].

Sospecha y diagnóstico
La consolidación del concepto de que la respiración nocturna debe ser considerada una nueva diana de las complicaciones tardías de la DM2 debería estrechar la relación entre endocrinólogos y neumólogos, pero especialmente la de éstos con los médicos de Atención Primaria. Sin embargo, todavía encontramos algunas lagunas clínicas que requieren una investigación más prolongada para poder ser solventadas.
Por ejemplo:
¿la evaluación del sueño debe realizarse a todos los pacientes con DM2?
¿podemos identificar a un perfil de paciente de mayor riesgo?
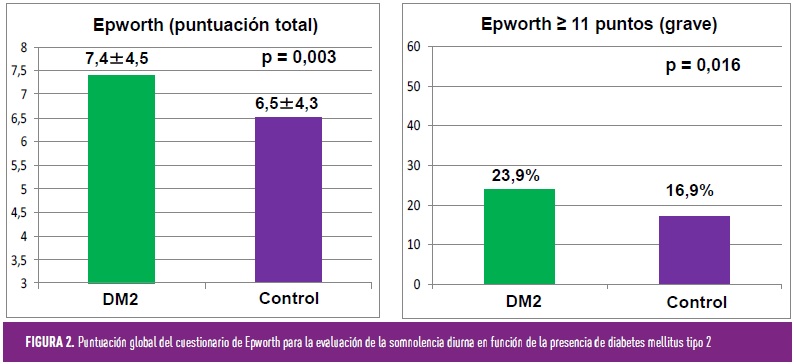
Quizás lo más sencillo sea comenzar por preguntar a los pacientes con DM2: la disrupción y fragmentación del sueño produce un aumento de la somnolencia diurna, la aparición de cefalea matutina y dificultades para la concentración, así como un mayor deterioro cognitivo, pérdida de productividad laboral y un incremento de accidentes de tráfico. Pues bien, es importante saber que la DM2 es un factor de riesgo independiente para una somnolencia diurna excesiva evaluada mediante el cuestionario de Epworth, característica que afecta al 23,9% de la población con diabetes (Figura 2)[8]. Además, el nivel de somnolencia diurna se relaciona, de manera independiente, con el sexo masculino, la presencia de diabetes y la hiperglucemia en ayunas.
Otro cuestionario breve y que apostamos por incluir en las visitas de rutina del paciente con DM2 es el STOP-BANG (Snoring, Tired, Observed, Pressure, BMI, Age, Neck and Gender), capaz de identificar el 90,6% de los pacientes con DM2 y SAHS. Recientemente, un panel francés de endocrinólogos y neumólogos justificó el cribado del SAHS en pacientes con DM2 y síntomas clínicos, e incluso sin síntomas en aquellos sujetos con complicaciones microvasculares o presión arterial no controlada[9]. No disponemos, en el momento actual, de marcadores biológicos que puedan ayudarnos en esta materia.
Utilidad de la mejora del control metabólico
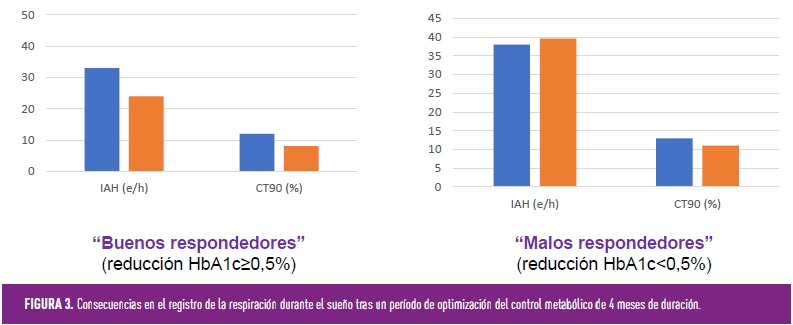
La mejora de los trastornos respiratorios del sueño en pacientes con DM2 a través de un mejor control metabólico se ha examinado a corto y medio plazo. En este contexto, los cambios en el peso corporal aparecen como el principal factor de confusión y extremadamente difícil de ser controlado. Recordemos que la obesidad abdominal es el principal factor de riesgo del SAHS e incluso reducciones moderadas del peso corporal se asocian con reducciones marcadas del IAH. Aun así, en un estudio de casos y controles con 30 pacientes con DM2 y 10 sujetos control, la optimización del control glucémico durante 5 días (durante los que no se apreciaron cambios significativos en el peso) logró una reducción significativa en los eventos de desaturación nocturna de oxígeno[10]. Recientemente se han publicado los resultados del estudio de intervención Candy Dreams, con 35 pacientes con DM2 y SAHS en quienes los parámetros respiratorios se evaluaron al inicio y tras un período de 4 meses; aquellos con una reducción de HbA1c ≥0,5% se consideraron “buenos respondedores”[11]. Tras excluir a aquellos participantes que disminuyeron su IMC ≥2 kg/m2, los “buenos respondedores” exhibieron una mejoría del 23,3% en su IAH [26,1 (8,6 – 95,0) vs. 20,0 (4,0 – 62,4) e/h, p=0,002] y un descenso del CT90 [13,3 (0,4 – 69,0) vs. 8,1 (0,4 – 71,2) %, p=0,002), consiguiendo reducir de manera significativa el porcentaje de SAHS moderado y grave (Figura 3). Sin embargo, no se observaron cambios en el grupo de no respondedores. Es importante destacar que el cambio en HbA1c durante los 4 meses de intensificación se correlacionó positivamente con disminuciones en el IAH (r =0,358, p =0,035) y negativamente con aumentos en la saturación mínima de oxígeno (r=-0,386, p=0,039).
Si bien faltan aún estudios a más largo plazo, sí se confirma que la mejora del control glucémico ejerce efectos beneficiosos sobre los parámetros respiratorios del sueño que no pueden atribuirse meramente a la pérdida de peso.
Importancia del tratamiento antidiabético utilizado
Las opciones terapéuticas utilizadas para mejorar el control metabólico puede ser también un tema de interés. En modelos experimentales se han observado efectos positivos de la metformina y la insulina sobre la respiración durante el sueño. Así, en ratas Sprage-Dawley resistentes a la insulina, el tratamiento oral con metformina no solo previno, sino que también revirtió los episodios de apnea[12].
El déficit subyacente de GLP-1 en la DM2 también podría estar involucrado en el deterioro de la respiración durante el sueño. En el estudio SCALE Sleep Apnea, tras 32 semanas de tratamiento, la administración diaria de 3,0 mg de liraglutida a pacientes con obesidad y SAHS moderado o grave produjo una mayor reducción porcentual media del IAH en comparación con el placebo (-12,2 vs.-6,6 e/h, p=0,015) [13]. Sin embargo, esta mejora en el IAH estuvo estrechamente relacionada con la pérdida de peso.
También se ha comunicado una reducción en el IAH y un aumento en la saturación arterial mínima de oxígeno en pacientes con un diagnóstico reciente de DM2 tratados durante 24 semanas con dapagliflozina, un inhibidor del cotransportador de sodio y glucosa 2, pero no en el grupo placebo[14].
En resumen, la evidencia acumulada apoya con firmeza el efecto deletéreo de la DM2 y el grado de control metabólico sobre la respiración durante el sueño, e indica que la calidad del descanso nocturno debe ser considerada por todos aquellos que tienen cuidado de las personas con diabetes.
Si bien los mecanismos patogénicos subyacentes en esta relación son diversos, parece que las vías metabólicas relacionadas con la resistencia a la insulina son cruciales en la iniciación de estas anormalidades.
Identificar a los sujetos con DM2 más vulnerable para la disfunción del descanso nocturno será, en los próximos años, uno de nuestros objetivos.
BIBLIOGRAFÍA
- Lecube A, Simó R, Pallayova M et al. Pulmonary Function and Sleep Breathing: Two New Targets for Type 2 Diabetes Care. Endocr Rev. 2017;38: 550-73.
- López-Cano C, Gutiérrez-Carrasquilla L, Barbé F et al. Effect of Type 2 Diabetes Mellitus on the Hypoxia-Inducible Factor 1-Alpha Expression. Is There a Relationship with the Clock Genes? J Clin Med. 2020; 9(8):2632.
- Lecube A, Sampol G, Lloberes P et al. Asymptomatic sleep-disordered breathing in premenopausal women awaiting bariatric surgery. Obes Surg. 2010; 20:454-61.
- Huang T, Lin BM, Stampfer MJ, Tworoger SS, Hu FB, Redline S. A Population-Based Study of the Bidirectional Association Between Obstructive Sleep Apnea and Type 2 Diabetes in Three Prospective U.S. Cohorts. Diabetes Care. 2018; 41:2111-2119.
- Sánchez E, Sapiña-Beltrán E, Gavaldà R et al. Prediabetes Is Associated with Increased Prevalence of Sleep-Disordered Breathing. J Clin Med. 2022;11:1413.
- Lecube A, Sampol G, Lloberes P et al. Diabetes is an independent risk factor for severe nocturnal hypoxemia in obese patients. A case-control study. PLoS One. 2009;4:e4692
- Lecube A, Sampol G, Hernandez C, Romero O, Ciudin A, Simo R. Characterization of sleep breathing pattern in patients with type 2 diabetes: sweet sleep study. PLoS One. 2015;10: e0119073.
- Lecube A, Sánchez E, Gómez-Peralta F et al. Global assessment of the impact of type 2 diabetes on sleep through specific questionnaires. A case-control study. PLoS One. 2016;11:e0157579.
- Borel AL, Tamisier R, Böhme P et al. Obstructive sleep apnoea syndrome in patients living with diabetes: ¿Which patients should be screened? Diabetes Metab. 2019;45:91-101.
- Lecube A, Ciudin A, Sampol G, Valladares S, Hernández C, Simó R. Effect of glycemic control on nocturnal arterial oxygen saturation: a case-control study in type 2 diabetic patients. J Diabetes. 2015;7:133–38.
- Gutiérrez-Carrasquilla L, López-Cano C, Sánchez E et al. Effect of Glucose Improvement on Nocturnal Sleep Breathing Parameters in Patients with Type 2 Diabetes: The Candy Dreams Study. J Clin Med. 2020;9:1022.
- Ramadan W, Dewasmes G, Petitjean M et al. Sleep apnea is induced by a high-fat diet and reversed and prevented by metformin in non-obese rats. Obesity (Silver Spring). 2007;15:1409–18.
- Blackman A, Foster GD, Zammit G et al. Effect of liraglutide 3.0 mg in individuals with obesity and moderate or severe obstructive sleep apnea: the SCALE Sleep Apnea randomized clinical trial. Int J Obes (Lond) 2016;40:1310-9.
- Tang Y, Sun Q, Bai XY, Zhou YF, Zhou QL, Zhang M. Effect of dapagliflozin on obstructive sleep apnea in patients with type 2 diabetes: a preliminary study. Nutr Diabetes. 2019; 9: 32.







