1. Introducción
La obesidad y la diabetes tipo 2 (DM2) son dos de las principales epidemias de salud en el mundo moderno. Durante décadas, el índice de masa corporal (IMC) se ha usado como una herramienta para estimar el riesgo metabólico de los individuos con exceso de peso. Sin embargo, la relación entre obesidad y diabetes va mucho más allá de un simple número que no tiene en cuenta la composición ni la distribución corporal de ese peso.
Entre las estructuras clave implicadas está el tejido adiposo que juega un papel central en la disfunción metabólica y que conduce a la resistencia a la insulina para, eventualmente en un gran número de casos, dar paso a la diabetes (1). A medida que el tejido graso crece y se enferma, se generan alteraciones sistémicas que afectan órganos clave como el hígado, el páncreas, el músculo esquelético y el sistema cardiovascular.
El exceso de tejido adiposo no solo promueve la DM2, sino que también agrava sus efectos, acelerando el deterioro de órganos esenciales para el individuo. A su vez, niveles elevados de insulina debidos a la resistencia favorecen la lipogénesis y la acumulación de grasa, especialmente en el tejido adiposo visceral.
Se establece por lo tanto un círculo vicioso entre ambas condiciones que conduce finalmente al desarrollo de complicaciones severas como la enfermedad renal, la aterosclerosis, la isquemia arterial y la insuficiencia cardíaca entre otras.
EL EXCESO DE TEJIDO ADIPOSO NO SOLO PROMUEVE LA DM2, SINO QUE TAMBIÉN AGRAVA SUS EFECTOS, ACELERANDO EL DETERIORO DE ÓRGANOS ESENCIALES PARA EL INDIVIDUO
2. El papel del tejido adiposo en la resistencia a la insulina
El tejido adiposo es un órgano endocrino altamente activo que regula el metabolismo a través de la secreción de hormonas y mediadores inflamatorios (2). En una persona con obesidad, el exceso de tejido graso sufre una transformación patológica caracterizada por:
- Hipertrofia e hiperplasia adipocitaria: en condiciones normales, los adipocitos almacenan energía en forma de triglicéridos. Sin embargo, cuando la cantidad de grasa acumulada excede la capacidad del tejido adiposo, los adipocitos crecen desmesuradamente (hipertrofia) o se generan nuevos adipocitos (hiperplasia).
- Inflamación crónica de bajo grado: la obesidad está asociada con un aumento en la producción de citoquinas proinflamatorias como el factor de necrosis tumoral alfa (TNF-α) y la interleucina-6 (IL-6), las cuales interfieren con la señalización de la insulina, favoreciendo la resistencia a la insulina.
- Lipólisis excesiva y acumulación de lípidos en órganos no adiposos: un tejido adiposo enfermo libera una gran cantidad de ácidos grasos libres al torrente sanguíneo, los cuales se depositan en órganos como el hígado, el páncreas y el músculo esquelético, generando disfunción en estos tejidos.
3. La restauración del mecanismo incretínico: una pieza clave del puzzle
Las incretinas, principalmente el péptido similar al glucagón tipo 1 (GLP-1) y el polipéptido insulinotrópico dependiente de glucosa (GIP), son hormonas secretadas por el intestino en respuesta a la ingesta de alimentos. Estas hormonas desempeñan un papel fundamental en la regulación de la glucosa al estimular la secreción de insulina de manera dependiente de los niveles de glucosa en sangre, lo que ayuda a mantener una glucemia estable. Además, el GLP-1 inhibe la secreción de glucagón, reduciendo la producción hepática de glucosa.
En cuanto a la adiposidad, las incretinas también influyen en la homeostasis energética al modular el almacenamiento de grasa. El GIP promueve la acumulación de lípidos en los adipocitos, mientras que el GLP-1 mejora la sensibilidad a la insulina y reduce la ingesta calórica. Por otro lado, las incretinas, desempeñan un papel protector al mejorar la sensibilidad hepática a la insulina y reducir la lipogénesis hepática.
El control del hambre y la saciedad también está estrechamente relacionado con la acción de las incretinas. Actúan sobre el sistema nervioso central, especialmente en el hipotálamo y el tronco encefálico, promoviendo la sensación de saciedad y reduciendo la ingesta de alimentos. También, disminuyen la velocidad a la que los alimentos pasan del estómago al intestino delgado, lo que prolonga la sensación de saciedad y reduce la ingesta calórica.
En conjunto, la regulación incretínica desempeña un papel esencial en la homeostasis glucémica y el control del peso corporal, lo que ha llevado al desarrollo de fármacos basados en incretinas para el tratamiento de la diabetes tipo 2 y la obesidad, donde subyace una alteración de su funcionamiento, corrigiéndose de esta manera el perfil metabólico general (3).
Actualmente, disponemos en España de varias opciones en esta categoría:
- Liraglutida.
- Dulaglutida.
- Semaglutida.
- Tirzepatida.
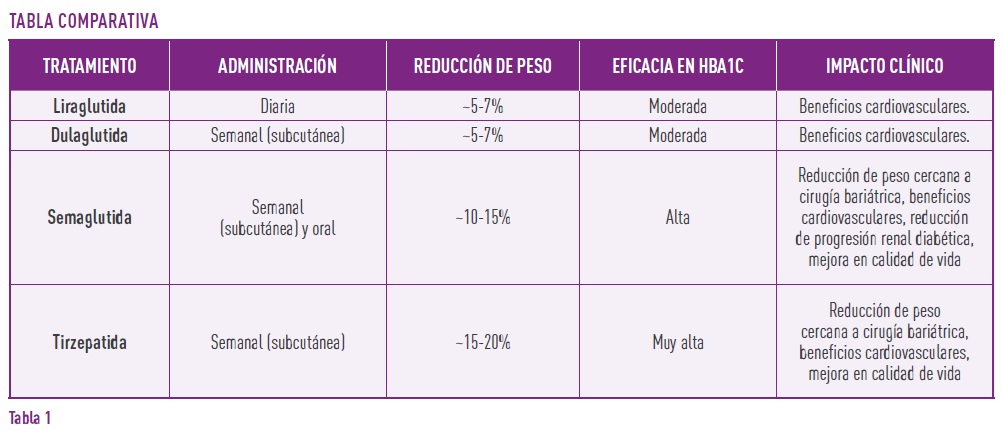
Si bien todos han demostrado beneficios en el control glucémico y en la reducción de peso, Semaglutida y Tirzepatida son los que presentan la mayor eficacia en ambas áreas, siendo considerados opciones de primera línea en pacientes con obesidad y diabetes tipo 2.
Comparación entre los principales tratamientos incretínicos (4, 5).
1. Liraglutida
- Administración diaria.
- Reducción de peso moderada (~5-7%).
- Beneficio cardiovascular demostrado.
2. Dulaglutida
- Administración semanal vía subcutánea.
- Reducción de peso similar a liraglutida.
- Protección cardiovascular también demostrada.
3. Semaglutida
- Disponible en formulaciones semanal vía subcutánea y oral.
- Mayor reducción de peso (~10-15%).
- Reducción de hemoglobina glucosilada (HbA1c) más eficaz que liraglutida y dulaglutida.
4. Tirzepatida (agonista dual GLP-1/GIP)
- Acción sobre dos vías incretínicas (GLP-1 y GIP).
- Reducción de peso superior a semaglutida (~15-20%).
- Mayor reducción de HbA1c, permitiendo un control glucémico más efectivo.
(Tabla 1).
Impacto clínico
Varios estudios clínicos han demostrado que Semaglutida y Tirzepatida ofrecen reducciones de peso cercanas a las obtenidas con cirugía bariátrica en algunos pacientes con obesidad severa. El uso de estos tratamientos además no solo mejora el control glucémico y la reducción de peso, sino que también ha demostrado beneficios adicionales como:
- Disminución del riesgo cardiovascular en pacientes con diabetes y obesidad.
- Reducción de la progresión de la enfermedad renal diabética.
- Mejoría en la funcionalidad y calidad de vida del paciente.

Conclusiones
La obesidad y la diabetes tipo 2 son enfermedades estrechamente interconectadas. El tejido adiposo enfermo desempeña un papel central en la aparición y progresión de la resistencia a la insulina, afectando múltiples órganos clave.
Los tratamientos incretínicos de última generación han demostrado ser una herramienta fundamental en el manejo de estas patologías, especialmente Semaglutida y Tirzepatida, que ofrecen un control glucémico superior y una pérdida ponderal significativa. Estas terapias no solo abordan la hiperglucemia, sino que también mejoran el perfil metabólico global y reducen el riesgo de complicaciones cardiovasculares y renales, representando una estrategia terapéutica de primer orden en la lucha contra la obesidad y la diabetes tipo 2.
Bibliografía
- Lingvay I, Sumithran P, Cohen RV, le Roux CW. Obesity management as a primary treatment goal for type 2 diabetes: time to reframe the conversation. Lancet. 2022 Jan 22;399(10322):394-405.
- Busebee B, Ghusn W, Cifuentes L, Acosta A. Obesity: A Review of Pathophysiology and Classification. Mayo Clin Proc. 2023 Dec;98(12):1842-1857
- Bailey CJ, Flatt PR, Conlon JM. An update on peptide-based therapies for type 2 diabetes and obesity. Peptides. 2023 Mar;161:170939. doi: 10.1016/j.peptides.2023.170939.
- Xie Z, Hu J, Gu H, Li M, Chen J. Comparison of the efficacy and safety of 10 glucagon-like peptide-1 receptor agonists as add-on to metformin in patients with type 2 diabetes: a systematic review. Front Endocrinol (Lausanne). 2023 Aug 28;14:1244432. doi: 10.3389/fendo.2023.1244432. PMID: 37701904; PMCID: PMC10493284.
- Latif W, Lambrinos KJ, Patel P, Rodriguez R. Compare and Contrast the Glucagon-Like Peptide-1 Receptor Agonists (GLP1RAs). 2024 Feb 25. In: StatPearls [Internet]. Treasure Island (FL): StatPearls Publishing; 2025 Jan–. PMID: 34283517.